题目内容
(14分)碳和氮的许多化合物在工农业生产和生活中有重要的作用。
(1)用CO2 和H2 合成CH3OH具有重要意义,既可以解决环境问题,还可解决能源危机。已知: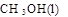 +
+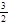
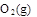 =
= 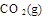 + 2
+ 2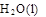 △H = -725.5 kJ·mol-1
△H = -725.5 kJ·mol-1
2H2 (g)+O2(g) = 2H2O(l) △H = -565.6 kJ·mol-1,
请写出工业上用CO2 和H2 合成CH3OH(l)的热化学方程式: ;
(2)一种新型燃料电池,一极通入空气,一极通入CH3OH(g),电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。则在该熔融电解质中,O2-向 (填“正”或“负”)极移动,电池负极电极反应为: ;
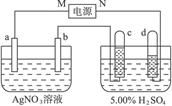
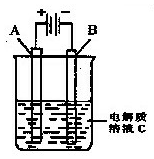
(3)如图是一个电化学装置示意图。用CH3OH-空气燃料电池做此装置的电源。如果A是铂电极,B是石墨电极,C是CuSO4溶液,通电一段时间后,向所得溶液中加入8 g CuO固体后恰好可使溶液恢复到电解前的浓度和pH.则电解过程中收集到标准状况下的气体体积为 ;
(4)常温下0.01 mol·L-1的氨水中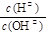 = 1×10- 6 ,则该溶液的pH为____,溶液中的溶质电离出的阳离子浓度约为 ;将 pH = 4的盐酸溶液V1 L与 0.01 mol·L-1氨水V2 L混合,若混合溶液pH = 7,则V1和V2的关系为:V1 V2(填“>”、“<”或“=”)。
= 1×10- 6 ,则该溶液的pH为____,溶液中的溶质电离出的阳离子浓度约为 ;将 pH = 4的盐酸溶液V1 L与 0.01 mol·L-1氨水V2 L混合,若混合溶液pH = 7,则V1和V2的关系为:V1 V2(填“>”、“<”或“=”)。
(1)用CO2 和H2 合成CH3OH具有重要意义,既可以解决环境问题,还可解决能源危机。已知:
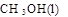 +
+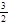
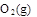 =
= 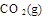 + 2
+ 2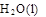 △H = -725.5 kJ·mol-1
△H = -725.5 kJ·mol-12H2 (g)+O2(g) = 2H2O(l) △H = -565.6 kJ·mol-1,
请写出工业上用CO2 和H2 合成CH3OH(l)的热化学方程式: ;
(2)一种新型燃料电池,一极通入空气,一极通入CH3OH(g),电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。则在该熔融电解质中,O2-向 (填“正”或“负”)极移动,电池负极电极反应为: ;
(3)如图是一个电化学装置示意图。用CH3OH-空气燃料电池做此装置的电源。如果A是铂电极,B是石墨电极,C是CuSO4溶液,通电一段时间后,向所得溶液中加入8 g CuO固体后恰好可使溶液恢复到电解前的浓度和pH.则电解过程中收集到标准状况下的气体体积为 ;

(4)常温下0.01 mol·L-1的氨水中
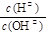 = 1×10- 6 ,则该溶液的pH为____,溶液中的溶质电离出的阳离子浓度约为 ;将 pH = 4的盐酸溶液V1 L与 0.01 mol·L-1氨水V2 L混合,若混合溶液pH = 7,则V1和V2的关系为:V1 V2(填“>”、“<”或“=”)。
= 1×10- 6 ,则该溶液的pH为____,溶液中的溶质电离出的阳离子浓度约为 ;将 pH = 4的盐酸溶液V1 L与 0.01 mol·L-1氨水V2 L混合,若混合溶液pH = 7,则V1和V2的关系为:V1 V2(填“>”、“<”或“=”)。(1)CO2(g) + 3H2(g)=CH3OH(l) + H2O(l) △H=-122.9 kJ·mol-1(2分)
(2)负(2分),CH3OH-6e-+3O2-=CO2 + 2H2O(2分)
(3)1.12 L(2分)
(4)10,10-4 mol·L-1 ; > (每空2分)
(2)负(2分),CH3OH-6e-+3O2-=CO2 + 2H2O(2分)
(3)1.12 L(2分)
(4)10,10-4 mol·L-1 ; > (每空2分)
(1)写出反应方程式:CO2(g)+3H2(g)=CH3OH(l)+H2O(l),再根据盖斯定律有目标方程式等于②×-①,故ΔH=×(-565.5)-(725.5)=-122.75 KJ/mol;(2)在原电池中阳离子向正极移动,阴离子向负极移动,燃料做负极,故负极反应为:CH3OH-6e-+3O2-=CO2 + 2H2O;(3)电解后加入CuO能恢复到原来状态,说明生成物为Cu和O2,8gCuO为0.1mol,故生成0.05mol氧气,标况下体积为1.12L;(4)===10-6,故c(H+)=10-10mol/L,pH=10,c(HCl)<c(NH3·H2O),现要呈中性,故有V1>V2。

练习册系列答案
相关题目
 △H=-38.6kJ·mol-1
△H=-38.6kJ·mol-1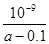

 2SO3,在一定温度下,反应达到平衡,得到0.12 mol SO3,则反应的平衡常数K= 。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO2的平衡浓度 (填“增大”“不变”或“减小”),氧气的转化率 (填“升高”“不变”或“降低”),SO3的体积分数 (填“增大”“不变”或“减小”)。
2SO3,在一定温度下,反应达到平衡,得到0.12 mol SO3,则反应的平衡常数K= 。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO2的平衡浓度 (填“增大”“不变”或“减小”),氧气的转化率 (填“升高”“不变”或“降低”),SO3的体积分数 (填“增大”“不变”或“减小”)。