题目内容
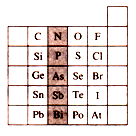
(14分)下表为一元素周期表(空白,未填元素)根据要求填空。
⑴ 在上面元素周期表中,全部是金属元素的区域为 (填字母代号)
A.甲 B.乙 C.丙 D.丁
⑵用实线画出金属与非金属的分界线(在答题卷图上完成)。
⑶已知R元素的某种原子的质量数为31,且原子核内质子数比中子数少1,请在答题卷中的周期表中标出“R”元素的位置(在答题卷图上完成)。
⑷在我们常用的周期表中,①元素的位置比较尴尬,它是第1列的唯一非金属元素。有人认为也可把①元素放在VIIA族,支持这个观点的物质是___ _______。
A.HF B.H+ C.NaH D.H2O2
⑸由①②③④四种元素形成的原子个数比为5:1:1:3一种离子化合物的化学式为__ ____;该化合物与过量⑤的氧化物的水化物微热时反应的离子方程式是 ;
若用球棍模型表示①和④形成的化合物的分子结构,应该是 。
| ① | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | ② | ③ | ④ | | |
| ⑤ | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | 丙 | | | 丁 |
| 甲 | | | | | | | | | | | | | | | | | |
| | | | | | | 乙 | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
A.甲 B.乙 C.丙 D.丁
⑵用实线画出金属与非金属的分界线(在答题卷图上完成)。
⑶已知R元素的某种原子的质量数为31,且原子核内质子数比中子数少1,请在答题卷中的周期表中标出“R”元素的位置(在答题卷图上完成)。
⑷在我们常用的周期表中,①元素的位置比较尴尬,它是第1列的唯一非金属元素。有人认为也可把①元素放在VIIA族,支持这个观点的物质是___ _______。
A.HF B.H+ C.NaH D.H2O2
⑸由①②③④四种元素形成的原子个数比为5:1:1:3一种离子化合物的化学式为__ ____;该化合物与过量⑤的氧化物的水化物微热时反应的离子方程式是 ;
若用球棍模型表示①和④形成的化合物的分子结构,应该是 。

(1)乙 (2)(3)略 (4)C
(5) NH4HCO3 NH4+ + HCO3- +2OH- NH3↑+CO32- +H2O。 B
NH3↑+CO32- +H2O。 B
(5) NH4HCO3 NH4+ + HCO3- +2OH-
 NH3↑+CO32- +H2O。 B
NH3↑+CO32- +H2O。 B考查元素周期表的结构和元素周期律的应用。
(1)在周期表中只有副族和第Ⅷ族全部是由金属元素构成的,选C。
(2)金属与非金属的分界线的起点是第ⅢA的硼和铝,终点是第ⅥA的Po和第ⅦA的At,如图所示(红线标记部分):
(3)R元素的某种原子的质量数为31,且原子核内质子数比中子数少1,所以其质子数为15,即为P元素,位于第三周期、第ⅤA。
(4)VIIA族的主要性质是氧化性,得1个电子即达到稳定性,表现为-1价,所以选项C正确。
(5)①②③④四种元素分别是H、C、N、O,所以原子个数比为5:1:1:3一种离子化合物的化学式为NH4HCO3。⑤的氧化物的水化物是氢氧化钠溶液,所以反应得离子方
程式为NH4+ + HCO3- +2OH- NH3↑+CO32- +H2O。①和④形成的化合物的分子式可以是H2O或H2O2,H2O不是直线型结构而是倒“V”型,所以答案是B。
NH3↑+CO32- +H2O。①和④形成的化合物的分子式可以是H2O或H2O2,H2O不是直线型结构而是倒“V”型,所以答案是B。
(1)在周期表中只有副族和第Ⅷ族全部是由金属元素构成的,选C。
(2)金属与非金属的分界线的起点是第ⅢA的硼和铝,终点是第ⅥA的Po和第ⅦA的At,如图所示(红线标记部分):
| ① | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | ② | ③ | ④ | | |
| ⑤ | | | | | | | | | | | | | | R | | | |
| | | | | | | | | | | | | | | 丙 | | | 丁 |
| 甲 | | | | | | | | | | | | | | | | | |
| | | | | | | 乙 | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
(4)VIIA族的主要性质是氧化性,得1个电子即达到稳定性,表现为-1价,所以选项C正确。
(5)①②③④四种元素分别是H、C、N、O,所以原子个数比为5:1:1:3一种离子化合物的化学式为NH4HCO3。⑤的氧化物的水化物是氢氧化钠溶液,所以反应得离子方
程式为NH4+ + HCO3- +2OH-
 NH3↑+CO32- +H2O。①和④形成的化合物的分子式可以是H2O或H2O2,H2O不是直线型结构而是倒“V”型,所以答案是B。
NH3↑+CO32- +H2O。①和④形成的化合物的分子式可以是H2O或H2O2,H2O不是直线型结构而是倒“V”型,所以答案是B。
练习册系列答案
相关题目