题目内容
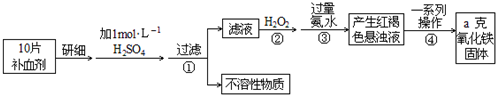
Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁.硫酸亚铁晶体在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:
请回答下列问题:
(1)步骤②加入过量H2O2的目的: ;
(2)步骤③中反应的离子方程式: ;
(3)步骤④中一系列处理的操作步骤: 、洗涤、 、冷却、称量.
(4)实验中用浓硫酸配制1mol/L的稀硫酸,配制时用到定量的玻璃仪器有 、 (答出两个仪器).
(5)若实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示).
【答案】分析:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,由流程图可知,加入H2O2是将Fe2+氧化为Fe3+;
(2)步骤③是将Fe3+转化为氢氧化铁沉淀;
(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(4)配制一定体积的1mol/L的稀硫酸,配制时需要的仪器有量筒、玻棒、烧杯、胶头滴管,容量瓶;
(5)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算.
解答:解:(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,故答案为:将Fe2+全部氧化为Fe3+;
(2)步骤③是将Fe3+转化为氢氧化铁沉淀,反应离子方程式为Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;
(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:过滤;灼烧;
(4)配制一定体积的1mol/L的稀硫酸,配制时需要的仪器有玻棒、烧杯、胶头滴管、容量瓶、量筒,故答案为:容量瓶;量筒;
(5)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量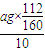 =0.07ag,
=0.07ag,
故答案为:0.07a.
点评:本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.
(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,由流程图可知,加入H2O2是将Fe2+氧化为Fe3+;
(2)步骤③是将Fe3+转化为氢氧化铁沉淀;
(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(4)配制一定体积的1mol/L的稀硫酸,配制时需要的仪器有量筒、玻棒、烧杯、胶头滴管,容量瓶;
(5)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算.
解答:解:(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,故答案为:将Fe2+全部氧化为Fe3+;
(2)步骤③是将Fe3+转化为氢氧化铁沉淀,反应离子方程式为Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;
(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:过滤;灼烧;
(4)配制一定体积的1mol/L的稀硫酸,配制时需要的仪器有玻棒、烧杯、胶头滴管、容量瓶、量筒,故答案为:容量瓶;量筒;
(5)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量
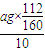 =0.07ag,
=0.07ag,故答案为:0.07a.
点评:本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

练习册系列答案
相关题目
 6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移 mol电子。
6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移 mol电子。