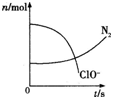
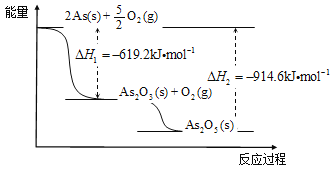
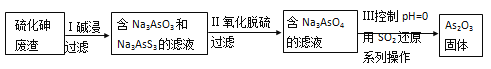
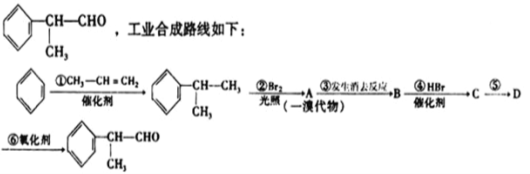
题目内容
【题目】化学与社会、生产、生活密切相关。下列说法不正确的是
A.高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B.我国油品从国IV汽油升级到国V汽油,有助于减少酸雨、雾霾,提高空气质量
C.臭氧是氧化性极强的淡蓝色气体,可用作自来水的消毒剂
D.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代普 通DNA链中的P元素
【答案】A
【解析】
试题分析:高纯度的二氧化硅用于制作光导纤维,故A错误;我国油品从国IV汽油升级到国V汽油,有助于减少酸雨、雾霾,提高空气质量,故B正确;.臭氧是强氧化剂,可用作自来水的消毒剂,故C正确;As、P同主族,性质相似,故D正确。

 阅读快车系列答案
阅读快车系列答案【题目】从能量的变化和反应的快慢等角度研究反应具有重要意义。
(1)已知反应2H2+O2 =2H2O为放热反应,下图能正确表示该反应中能量变化的是 。

化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如右表:则生成1mol水可以放出热量____________kJ
(2)原电池可将化学能转化为电能。将质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是 , 正极的反应式为 ,电解质溶液中SO42- 移向 极(填“正”或“负”)。一段时间后,取出洗净、干燥、称量,二者质量差为12.9 g。则导线中通过的电子的物质的量是 mol。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。