题目内容
如图,常温下单质A、B为气体,单质C为固体,分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族,E常温下为液体,G、H为黑色固体,D是常见金属。(反应条件多数略去)
回答下列问题:
(1)化合物E、M的沸点____________高(填化学式),原因是_______________________。
(2)甲、乙两种元素还可以形成一种含有4个原子核和18个电子的化合物,该化合物的结构式为_________________________________。
(3)E与D高温反应的化学方程式为________________________,K与M在水溶液中反应的离子方程式为____________________________________________。
(4)实验室在保存L溶液时,需加入少量D,理由是________________________,实验室检验L的水溶液中的阳离子的方法是________________________________________。
(5)已知一定条件下每1 mol F与单质B完全反应生成I放热98.0 kJ,若2 mol F与1 mol B在此条件下发生反应,达平衡时,放出热量为176.4 kJ,则F的转化率为____________,平衡时F的物质的量为____________,若保持温度和压强不变(反应混合物都为气体)按下列四种配比作为起始物质充入,达到平衡时各物质的物质的量与上述平衡状态相同的是_______________。
A.4 mol F 2 mol B
B.2 mol F 1 mol B 2 mol I
C.1 mol F 0.5 mol B 1 mol I
D.3 mol I 1 mol Ne
(1)H2O H2O分子之间存在氢键
(2)H—O—O—H
(3)4H2O(g)+3Fe![]() Fe3O4+4H2
Fe3O4+4H2
2Fe3++H2S![]() S↓+2Fe2++2H+
S↓+2Fe2++2H+
(4)防止Fe2+被氧化为Fe3+
溶液中加KSCN溶液没现象,滴加氯水(或溴水)后变红(或滴加NaOH溶液,先出现白色沉淀,后迅速转化为灰绿色,最后转化为红褐色)
(5)90% 0.2 mol C
解析:无机推断题主要是要找到题眼即突破口。由原子核外电子数等于其电子层数可得甲为H元素;E常温下为液体一般为水;由D+E![]() A+H结合前面信息可得出D为Fe,H为Fe3O4,B为O2,C为S,F为SO2,I为SO3,G为FeS,J为H2SO4,K为Fe2(SO4)3,L为FeSO4,M为H2S。(1)由于水能形成氢键,故沸点H2O>H2S。(5)由热化学方程式可求出F的转化率为90%,平衡时F的物质的量为0.2 mol;恒温恒压条件下,由于反应前后气体体积不等,故要想构成等效平衡,必须满足的条件是转换成一端的量必须与原平衡完全相同,故选C。
A+H结合前面信息可得出D为Fe,H为Fe3O4,B为O2,C为S,F为SO2,I为SO3,G为FeS,J为H2SO4,K为Fe2(SO4)3,L为FeSO4,M为H2S。(1)由于水能形成氢键,故沸点H2O>H2S。(5)由热化学方程式可求出F的转化率为90%,平衡时F的物质的量为0.2 mol;恒温恒压条件下,由于反应前后气体体积不等,故要想构成等效平衡,必须满足的条件是转换成一端的量必须与原平衡完全相同,故选C。

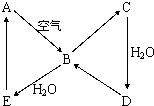 (2008?海南)如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
(2008?海南)如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料. 如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去).
如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去). 如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.