题目内容
【题目】利用人工模拟光合作用合成甲酸的原理为:2CO2+2H2O![]() 2HCOOH+O2,装置如图所示,下列说法不正确的是( )
2HCOOH+O2,装置如图所示,下列说法不正确的是( )

A. 电子由电极1经过负载流向电极2
B. 若将质子膜换成阴离子交换膜,该电池依然能够正常工作
C. 电极2的反应式:CO2+2H++2e﹣=HCOOH
D. 该装置能将太阳能转化为化学能和电能
【答案】B
【解析】
离子交换膜为质子膜,则电解质溶液为酸性,根据方程式分析,该反应中碳元素化合价由+4价变为+2价,氧元素化合价从-2价变为0价,所以1为负极,2是正极,负极上水失去电子生成氢离子和氧气,电子由负极沿导线流向正极,2是正极,正极上二氧化碳得到电子和氢离子反应生成甲酸,通过光照,该装置是太阳能转化为化学能和电能。A.电子从负极流出经过负载流向正极,1是负极,2是正极,所以电子从电极1经过负载流向电极2,故正确;B.若质子膜换成阴离子交换膜时,质子无法通过交换膜,不能平衡电荷,正极上无法按照原来的路径反应,电池不能正常工作,故错误;C.电极2的反应为二氧化碳得到电子结合氢离子生成甲酸,电极反应为CO2+2H++2e﹣=HCOOH,故正确;D.通过光照,该装置将太阳能转化为化学能和电能,故正确。故选B。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如表所示:下列有关叙述不正确的是( )
,在不同的温度下该反应的平衡常数如表所示:下列有关叙述不正确的是( )
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO为0.4 mol,则该反应达到平衡状态
D. 若平衡浓度符合下列关系式:![]() =
=![]() ,则此时的温度为1 000 ℃
,则此时的温度为1 000 ℃
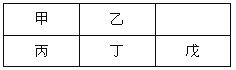
【题目】如表为元素周期表的一部分.
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为______________________。
(2)表中元素原子半径最大的是(写元素符号)_____________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁生成的1mol化合物Q与水反应生成2mol Mg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为_________。Q与水反应的化学方程式为____。
(5)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2molL-1NaOH溶液和1mol O2,则两种气体的分子式及物质的量分别为____________。生成硫酸铜物质的量为_____________。
【题目】某温度T1时,向容积为2L的恒容密闭容器中充入一定量的H2和I2(g),发生反应:H2(g)+I2(g) ![]() 2HI(g),反应过程中测定的部分数据见下表(表中t2>t1)。下列说法正确的是
2HI(g),反应过程中测定的部分数据见下表(表中t2>t1)。下列说法正确的是
反应时间/min | n(H2)/mol | n(I2)/mol |
0 | 0.9 | 0.3 |
t1 | 0.8 | |
t2 | 0.2 |
A. 反应在tmin内的平均速率为:v(H2)=![]() mol-1·L-1·min-l
mol-1·L-1·min-l
B. 保持其他条件不变,向平衡体系中再通0.20molH2,与原平衡相比,达到新平衡时I2(g)转化率增大,H2的体积分数不变
C. 保持其他条件不变,起始时向容器中充入的H2和I2(g)都为0.5mol,达到平衡时 n(HI)=0.2mol
D. 升高温度至T2时,上述反应平衡常数为0.18,则正反应为吸热反应