题目内容
下列有关物质的性质和该性质的应用均正确的是( )
| A、常温下浓硝酸能使铝发生钝化,可在常温下用铝制贮藏贮运浓硝酸 |
| B、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C、ClO2具有还原性,可用于对自来水的杀菌消毒 |
| D、铜的金属活泼性比铁的差,所以氯化铁溶液不能溶解铜 |
考点:硝酸的化学性质,硅和二氧化硅,铜金属及其重要化合物的主要性质
专题:
分析:A.常温下Al在浓硝酸中生成致密的氧化物保护膜,阻止内部金属继续反应,发生钝化现象;
B.二氧化硅能与氢氟酸反应;
C.ClO2用于对自来水的杀菌消毒,利用其氧化性;
D.铁离子氧化性比较铜离子强,Cu与氯化铁反应生成氯化亚铁与氯化铜.
B.二氧化硅能与氢氟酸反应;
C.ClO2用于对自来水的杀菌消毒,利用其氧化性;
D.铁离子氧化性比较铜离子强,Cu与氯化铁反应生成氯化亚铁与氯化铜.
解答:
解:A.常温下Al在浓硝酸中发生钝化现象,生成致密的氧化物保护膜,阻止内部金属继续反应,可在常温下用铝制贮藏贮运浓硝酸,故A正确;
B.二氧化硅能与氢氟酸反应生成四氟化硅与水,故B错误;
C.ClO2具有氧化性、还原性,但用于对自来水的杀菌消毒,是利用其氧化性,故C错误;
D.Cu与氯化铜没有发生置换反应,由于铁离子氧化性比较铜离子强,Cu与氯化铁反应生成氯化亚铁与氯化铜,故D错误,
故选A.
B.二氧化硅能与氢氟酸反应生成四氟化硅与水,故B错误;
C.ClO2具有氧化性、还原性,但用于对自来水的杀菌消毒,是利用其氧化性,故C错误;
D.Cu与氯化铜没有发生置换反应,由于铁离子氧化性比较铜离子强,Cu与氯化铁反应生成氯化亚铁与氯化铜,故D错误,
故选A.
点评:本题考查元素化合物性质,涉及N、Si、Cl、Fe元素化合物,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
下列叙述中能证明次氯酸是一种弱酸的是( )
| A、次氯酸不稳定,易分解 |
| B、次氯酸是一种强氧化剂 |
| C、次氯酸钙能与碳酸作用生成碳酸钙和次氯酸 |
| D、次氯酸能使染料和有机色质褪色 |
在15mL苯中溶解560mL乙炔,再加入75g苯乙烯,所得混和液中碳元素的质量分数为( )
| A、40% | B、66.7% |
| C、75% | D、92.3% |
下表为部分短周期元素的原子半径及主要化合价,根据表中信息判断,下列叙述正确的是( )
| 元素代号 | X | Y | Z | M | N |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
| A、X、Y最高价氧化物对应水化物的碱性:Y>X |
| B、M、N形成的简单离子的还原性:N->M- |
| C、气态氢化物的稳定性:HM<H2Z |
| D、最高价氧化物对应的水化物的酸性:H2ZO4>HNO4 |
化学与生产、生活、社会密切相关,下列说法正确的是( )
| A、煤经气化和液化两个物理过程后可变为清洁能源,这是煤综合利用的主要方法 |
| B、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |
| C、利用风能发电、使用太阳能热水器、应用无氟制冷剂均有利于降低大气中的二氧化碳 |
| D、积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料 |
下列表达方式错误的是( )
A、碳-12原子
| ||
B、氟化钠的电子式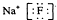 | ||
| C、硫离子的核外电子排布式 1s22s22p63s23p4 | ||
D、甲烷的电子式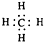 |
下列各组物质不属于同分异构体的是( )
| A、1,3-丁二烯和环丁烷 |
| B、邻氯甲苯和对氯甲苯 |
| C、2-甲基丁烷和戊烷 |
| D、2,2-二甲基丙醇和2-甲基丁醇 |