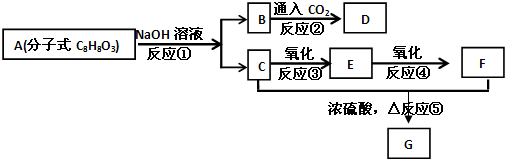
题目内容
某化学兴趣小组要完成中和热的测定.(已知t1为NaOH和HCl起始温度平均值,t2为终止温度.弱电解质电离是吸热的)
(1)实验桌上备有烧杯(大.小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、温度计、0.5mol?L-1 盐酸、0.55mol?L-1NaOH溶液,实验尚缺少的玻璃用品是 、 .
(2)他们记录的实验数据在表格中.
已知:Q=Cm(t2-t1),反应后溶液的比
热容C为4.18KJ?℃-1?Kg-1,各溶液的密度均为1g?cm-3.请根据实验结果(计算中和热结果保留一位小数)写出NaOH溶液与HCl溶液反应的热化学方程式:
(3)该小组所测得中和热与57.3kJ?mol-1有偏差,产生偏差的原因可能是
A、实验装置保温隔热效果差
B、量取NaOH溶液的体积时俯视读数
C、NaOH溶液分几次倒入盐酸中
D、用温度计测定NaOH溶液起始温度后,将温度计洗净擦干再测定盐酸溶液的温度
(4)实验中若用50mL 0.5mol?L-1 醋酸代替HCl溶液(其他操作不变),则测得的中和热会有偏差,其原因是 .
| 实 验 用 品 | 溶 液 温 度 | 中和热 △H | |||
| t1 | t2 | ||||
| ① | 50mL 0.55mol?L-1 NaOH | 50mL 0.5mol?L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL 0.55mol?L-1 NaOH | 50mL 0.5mol?L-1HCl | 20℃ | 23.5℃ | |
(2)他们记录的实验数据在表格中.
已知:Q=Cm(t2-t1),反应后溶液的比
热容C为4.18KJ?℃-1?Kg-1,各溶液的密度均为1g?cm-3.请根据实验结果(计算中和热结果保留一位小数)写出NaOH溶液与HCl溶液反应的热化学方程式:
(3)该小组所测得中和热与57.3kJ?mol-1有偏差,产生偏差的原因可能是
A、实验装置保温隔热效果差
B、量取NaOH溶液的体积时俯视读数
C、NaOH溶液分几次倒入盐酸中
D、用温度计测定NaOH溶液起始温度后,将温度计洗净擦干再测定盐酸溶液的温度
(4)实验中若用50mL 0.5mol?L-1 醋酸代替HCl溶液(其他操作不变),则测得的中和热会有偏差,其原因是
考点:中和热的测定
专题:实验题
分析:(1)根据量热计的构造和实验步骤来确定实验的仪器;
(2)先根据Q=m?c?△T计算反应放出的热量,然后根据△H=-
kJ/mol计算出中和热,然后根据中和热写出热化学方程式;
(3)A.装置保温、隔热效果差,测得的热量偏小;
B.量取NaOH溶液的体积时俯视读数,会导致所量的氢氧化钠体积偏小,放出的热量偏低;
C.NaOH溶液分几次倒入盐酸中,热量散失,测得的温度偏小;
D.用温度计测定NaOH溶液起始温度后,将温度计洗净擦干再测定盐酸;
(4)根据弱电解质电离吸热分析;
(2)先根据Q=m?c?△T计算反应放出的热量,然后根据△H=-
| Q |
| n |
(3)A.装置保温、隔热效果差,测得的热量偏小;
B.量取NaOH溶液的体积时俯视读数,会导致所量的氢氧化钠体积偏小,放出的热量偏低;
C.NaOH溶液分几次倒入盐酸中,热量散失,测得的温度偏小;
D.用温度计测定NaOH溶液起始温度后,将温度计洗净擦干再测定盐酸;
(4)根据弱电解质电离吸热分析;
解答:
解:(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、搅拌器以及量筒;
故答案为:量筒;环形玻璃搅拌棒;
(2)50mL 0.55mol?L-1 NaOH与50mL 0.5mol?L-1HCl进行中和反应生成水的物质的量为0.05L×0.50mol=0.025mol,溶液的质量为:100ml×1g/cm3=100g,温度变化的值△T=
=3.4℃,则生成0.025mol水放出的热量为Q=m?c?△T=100g×4.18J/(g?℃)×3.4℃=1421.2J=1.4212KJ,所以实验测得的中和热△H=-
kJ/mol=-56.8kJ/mol,NaOH溶液与HCl溶液反应的热化学方程式为:
NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-56.8 kJ?mol-1,
故答案为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-56.8 kJ?mol-1;
(3)A.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故A正确;
B.量取NaOH溶液的体积时俯视读数,会导致所量的氢氧化钠体积偏小,放出的热量偏低,中和热的数值偏小,故B正确;
C.NaOH溶液分几次倒入盐酸中,热量散失,测得的温度偏小,中和热的数值偏小,故C正确;
D.用温度计测定NaOH溶液起始温度后,将温度计洗净擦干再测定盐酸溶液的温度,操作正确,故D错误;
故答案为:ABC;
(4)醋酸为弱酸,电离过程为吸热过程,所以醋酸(CH3COOH)代替HCl溶液反应,反应放出的热量小于57kJ,故答案为:醋酸是弱电解质,电离出氢离子要吸收热量,致使中和热数值偏低;
故答案为:量筒;环形玻璃搅拌棒;
(2)50mL 0.55mol?L-1 NaOH与50mL 0.5mol?L-1HCl进行中和反应生成水的物质的量为0.05L×0.50mol=0.025mol,溶液的质量为:100ml×1g/cm3=100g,温度变化的值△T=
| 3.3℃+3.5℃ |
| 2 |
| 1.4212KJ |
| 0.025mol |
NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-56.8 kJ?mol-1,
故答案为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-56.8 kJ?mol-1;
(3)A.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故A正确;
B.量取NaOH溶液的体积时俯视读数,会导致所量的氢氧化钠体积偏小,放出的热量偏低,中和热的数值偏小,故B正确;
C.NaOH溶液分几次倒入盐酸中,热量散失,测得的温度偏小,中和热的数值偏小,故C正确;
D.用温度计测定NaOH溶液起始温度后,将温度计洗净擦干再测定盐酸溶液的温度,操作正确,故D错误;
故答案为:ABC;
(4)醋酸为弱酸,电离过程为吸热过程,所以醋酸(CH3COOH)代替HCl溶液反应,反应放出的热量小于57kJ,故答案为:醋酸是弱电解质,电离出氢离子要吸收热量,致使中和热数值偏低;
点评:本本题主要考查了中和热的测定、误差分析以及中和热的热化学方程式的书写,综合性较强,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
据调查,许多质量较差的家庭装饰材料会释放出近百种能引发疾病的有害物质,三氯乙烯是其中一种,其化学式为C2HCl3.下面关于三氯乙烯的说法正确的是( )
| A、是一种烯烃 |
| B、可由乙炔和氯化氢加成而得 |
| C、分子中所有原子在同一个平面上 |
| D、通入AgNO3溶液能产生白色沉淀 |
下列物质的化学用语不正确的是( )
| A、乙酸乙酯的最简式:C2H4O |
B、乙烯的比例模型: |
C、甲烷分子的球棍模型: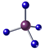 |
| D、乙烷的结构式:CH3CH3 |
下列有关物质的性质和该性质的应用均正确的是( )
| A、常温下浓硝酸能使铝发生钝化,可在常温下用铝制贮藏贮运浓硝酸 |
| B、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C、ClO2具有还原性,可用于对自来水的杀菌消毒 |
| D、铜的金属活泼性比铁的差,所以氯化铁溶液不能溶解铜 |