题目内容
【题目】在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是( ) 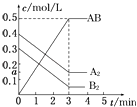
A.图中a点的值为0.15
B.该反应的平衡常数K=0.03
C.温度升高,平衡常数K值减小
D.平衡时A2的转化率为62.5%
【答案】B
【解析】解:A、当AB的浓度改变0.5 molL﹣1 , 由方程式知,A2的浓度改变为0.25molL﹣1 , 所以a=(0.4﹣0.25)molL﹣1=0.15molL﹣1 , 即图中a点的值为0.15,故A正确;
B、当AB的浓度改变0.5 molL﹣1 , 由方程式知,B2的浓度改变为0.25molL﹣1 , 所以平衡时B2的浓度为=(0.3﹣0.25)molL﹣1=0.05molL﹣1 , K= ![]() =
= ![]() =
= ![]() ,故B错误;
,故B错误;
C、已知A2(g)+B2(g)2AB(g)△H<0,所以温度升高,平衡逆移,平衡常数K值减小,故C正确;
D、当AB的浓度改变0.5 molL﹣1 , 由方程式知,A2的浓度改变为0.25molL﹣1 , 已知A2的初始量为0.4molL﹣1 , 所以平衡时A2的转化率为 ![]() ×100%=62.5%,故D正确;
×100%=62.5%,故D正确;
故选B.
A、根据v= ![]() 计算反应速率,根据AB的浓度变化计算A2的浓度变化,从而得出a值;
计算反应速率,根据AB的浓度变化计算A2的浓度变化,从而得出a值;
B、根据图象中数据计算,化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;
C、根据温度对平衡的影响分析;
D、根据转化的A2的量和A2的初始量求算.

练习册系列答案
相关题目