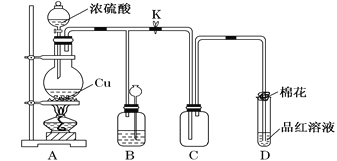
题目内容
【题目】某待测溶液中可能含有SO42﹣、SO32﹣、CO32﹣、HCO3﹣、NO3﹣、Cl﹣、Br﹣中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出).
请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填):
肯定存在的离子 | 肯定没有的离子 | |
化学式或离子符号 |
(2)出沉淀A三种可能的情况: , 若气体D遇空气变红棕色,则生成沉淀D时肯定发生的反应的离子方程式为 .
(3)若Mn+位于第三周期,则要确定它具体是何种离子的方法是 .
【答案】
(1)HCO3 ? ;Br﹣
(2)BaSO3;BaSO3、BaSO4;BaCO3、BaSO4;BaCO3、BaSO3;BaSO3、BaCO3、BaSO4;3BaSO3+2H++2NO3﹣═2NO↑+3BaSO4↓+H2O
(3)做焰色反应实验,观察到黄色火焰,则说明是钠
【解析】解:(1)沉淀A与稀硝酸反应仍得到白色沉淀知白色沉淀D为BaSO4 , 由于还生成气体D,气体D可能是稀硝酸与SO32﹣发生氧化还原反应生成的N0,还可能是稀硝酸与CO32﹣反应CO2 , 或两者均有,故溶液中SO42﹣、SO32﹣至少有一种,SO32﹣、CO32﹣至少有一种;由每次实验所用试剂均足量知溶液A中含有Ba2+ , 在加入碱后能得到白色沉淀B,则原待测溶液中一定含有HCO3﹣;溶液B中加入足量的氯水后仍得到无色溶液,说明原待测液中无Br﹣ , 不能确定是否有NO3﹣、CO32﹣、Cl﹣ , 根据以上分析可知,原待测溶液中一定含有HCO3﹣;一定没有无Br﹣;所以答案是:
肯定存在的离子 | 肯定不存在的离子 | |
化学式或离子符号 | HCO | Br﹣ |
·(2)沉淀A与稀硝酸反应仍得到白色沉淀知白色沉淀D为BaSO4 , 由于还生成气体D,气体D可能是稀硝酸与SO32﹣发生氧化还原反应生成的N0,还可能是稀硝酸与CO32﹣反应CO2 , 或两者均有,故溶液中SO42﹣、SO32﹣至少有一种,SO32﹣、CO32﹣至少有一种,故沉淀A可能只有BaSO3 , 可能为BaSO3、BaSO4 , 可能为BaCO3、BaSO4 , 可能为BaCO3、BaSO3 , 还可能为BaSO3、BaCO3、BaSO4;若气体D遇空气变红色时,表明D中肯定有NO,沉淀A中肯定有BaSO3 , 生成沉淀D的离子方程式为:3BaSO3+2H++2NO3﹣═2NO↑+3BaSO4↓+H2O,所以答案是:BaSO3;BaSO3、BaSO4;BaCO3、BaSO4;BaCO3、BaSO3;BaSO3、BaCO3、BaSO4;3BaSO3+2H++2NO3﹣═2NO↑+3BaSO4↓+H2O;(3)处于第三周期的金属阳离子有Na+、Mg2+、Al3+ , 由于Al3+与HCO3﹣不能大量共存,故金属阳离子不可能是Al3+ , 即Mn+只能是Na+或K+ , 可通过焰色实验来确定是镁还是钠,所以答案是:做焰色反应实验,观察到黄色火焰,则说明是钠.

 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中元素________(填写元素符号)的非金属性最强;元素________(填写元素符号)的金属性最强,写出它与水反应的离子方程式__________________________________。
(2)表中元素③的原子结构示意图是________。
(3)表中元素⑥、⑦氢化物的稳定性顺序为________>________(填写化学式,下同)。
(4)表中元素最高价氧化物对应水化物酸性最强的酸的分子式是_________________。