题目内容
【题目】用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
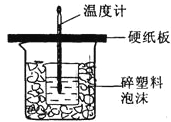
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。
(2)烧杯间填满碎纸条的作用是___________________。
(3)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等、不相等”)。所求中和热__________(填“相等、不相等”)。简述理由__________________________________________________。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会______________(填“偏大”、“偏小”、“无影响”)。
(5)利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值。
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-42.3kJ·mol-1
甲烷和水蒸气生成二氧化碳和氢气的热化学方程式_______________________________。
【答案】 环形玻璃搅拌棒 减少实验过程中的热量损失 不相等 相等 因为中和热是指酸跟碱发生中和反应生成1mol·H2O所放出的热量,与酸碱的用量无关 偏小 CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+163.9kJ·mol-1
【解析】分析:(1)根据量热计的构造来判断该装置的缺少仪器;
(2)根据中和热测定实验成败的关键是保温工作,据此解答;
(3)反应放出的热量和所用酸以及碱的量的多少有关,根据中和热的概念和实质来回答;
(4)根据一水合氨存在电离平衡分析;
(5)根据盖斯定律计算。
详解:(1)由量热计的构造可知该装置缺少的仪器是环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是减少实验过程中的热量损失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关,因此所得的中和热相等;
(4)氨水中存在一水合氨的电离平衡,电离吸热,因此用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小;
(5)已知:
①CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-42.3kJ·mol-1
根据盖斯定律可知①+②即得到甲烷和水蒸气生成二氧化碳和氢气的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+163.9kJ·mol-1。

 特高级教师点拨系列答案
特高级教师点拨系列答案【题目】将一铁、铜混合物粉末平均分成三等份,分别加入到同浓度、不同体积的稀硝酸中,充分反应后,收集到NO气体的体积及剩余固体的质量如表 (设反应前后溶液的体积不变,气体体积已换算为标准状况时的体积):
实验序号号 | 稀硝酸的体积/mL | 剩余固体的质量/g | NO的体积/L |
① | 100 | 17.2 | 2.24 |
② | 200 | 8.00 | 4.48 |
③ | 400 | 0 | V |
下列说法正确的是( )
A.表中 V=7.84 L
B.原混合物粉末的质量为25.6 g
C.原混合物粉未中铁和铜的物质的量之比为2:3
D.实验3所得溶液中硝酸的物质的量浓度为0.875 molL﹣1