题目内容
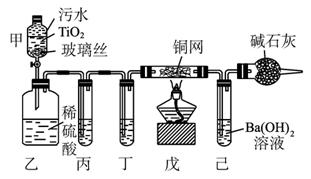
环境保护是我国的一项基本国策。含CN-的污水毒性和危害极大,治理含CN-污水的方法之一是在催化剂TiO2作用下,用NaClO将CN-氧化成CNO-,CNO-在酸性条件下继续被NaClO氧化成CO2、N2。某科研部门用下图所示装置进行模拟实验,以证明上述处理含CN-污水方法的有效性,并测定CN-被处理的百分率,下述实验装置是通过测定CO2的量来确定CN-的处理效果。 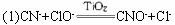
操作过程为:将浓缩后含CN-的污水(其中CN-浓度为0.05 mol·L-1)200 mL倒入甲装置中,再向甲装置中加入过量的漂白粉溶液,塞上橡胶塞,一段时间后,打开活塞,使溶液全部进入乙中,关闭活塞。试根据要求完成下列问题:
(1)甲中反应的离子方程式为:_______________________________________;乙中反应的离子方程式为:__________________________________________________。
(2)乙装置中生成的气体除含有CO2、N2、HCl外还有副反应生成的Cl2等,写出生成Cl2的副反应的离子方程式:_______________________________________________________。
(3)丙中加入的除杂试剂是____________(填序号)。
A.饱和食盐水 B.饱和碳酸氢钠溶液
C.浓NaOH溶液 D.浓硫酸
(4)丁在实验中的作用是______________________________________________。
(5)戊中盛有足量的石灰水,若实验后戊中共生成0.8 g沉淀,则该实验中CN-被处理的百分率(填“>”“=”或“<”)____________80%。
![]()
2CNO-+3ClO-+2H+====N2↑+2CO2↑+3Cl-+H2O
(2)Cl-+ClO-+2H+====Cl2↑+H2O
(3)A
(4)除去混合气体中的Cl2
(5)>
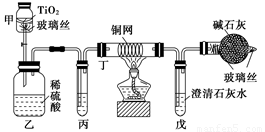
解析:解答此类实验题,首先要明白实验原理,①CN-+ClO-![]() CNO-+Cl-,②CNO-+ClO-
CNO-+Cl-,②CNO-+ClO-![]() CO2↑+N2;③Ca(OH)2+CO2
CO2↑+N2;③Ca(OH)2+CO2![]() CaCO3↓。其次要弄清各装置的作用,甲装置发生反应①,乙装置发生反应②,戊装置发生反应③,丙装置吸收杂质气体HCl,丁装置除去Cl2。再认真分析产生误差的原因,由于反应产生的CO2有一部分滞留在装置乙、丙、丁、戊中,不会被石灰水完全吸收,因此CN-被处理的百分率大于80%。
CaCO3↓。其次要弄清各装置的作用,甲装置发生反应①,乙装置发生反应②,戊装置发生反应③,丙装置吸收杂质气体HCl,丁装置除去Cl2。再认真分析产生误差的原因,由于反应产生的CO2有一部分滞留在装置乙、丙、丁、戊中,不会被石灰水完全吸收,因此CN-被处理的百分率大于80%。

 名校课堂系列答案
名校课堂系列答案