题目内容
【题目】钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。
(1)T℃时,WO3 经如下的四步反应生成 W。每一步反应的焓变和平衡常数如下:
WO3(s)+0.1H2(g)![]() WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.18H2(g)![]() WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.72H2(g)![]() WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+2H2(g)![]() W(s)+2H2O(g) △H4 K4
W(s)+2H2O(g) △H4 K4
则该温度下,WO3(s)+3H2(g)![]() W(s)+3H2O(g) K=_____。
W(s)+3H2O(g) K=_____。
(2)T1℃时,将 4molH2 和足量 WO3 置于 2 L 密闭容器中,发生反应:O3(s)+3H2(g)![]() W(s)+3H2O(g)
W(s)+3H2O(g)
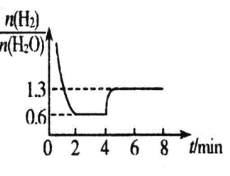
混合气体各组分物质的量之比随时间变化的关系如图所示:
①下列选项中能说明反应已经达到平衡的是_____。(填字母)
a.反应速率ν(H2)=ν(H2O)
b.每断裂 3molH-H 键的同时断裂 3molO-H 键
c.反应热不变
d.混合气体的密度不再改变 e.体系的压强不再改变
②反应在 2min 时达到平衡,此时 H2 的平衡转化率 a=_____%。
③若在 4 min 时升高并维持温度为 T2℃,变化如图所示,则该反应的△H_____0,若在 8min 时缩小 容器容积,则n(H2)/n(H2O)________1.3。(填“>”“ <”或“=”)
(3)利用电解法可以从合金碳化钨(WC)废料中回收钨元素(合金中钨、碳均为单质)。电解时,用合 金碳化钨做阳极,不锈钢做阴极,盐酸溶液为电解液,阳极析出钨酸(H2WO4)并放出 CO2。该阳极的电 极反应式为__________________________________。
【答案】K1K2K3K4d62.5<=WC+6H2O-10e-=H2WO4↓+CO2↑+10H+
【解析】
(1)①WO3(s)+0.1H2(g)![]() WO2.9(s)+0.1H2O(g) K1
WO2.9(s)+0.1H2O(g) K1
②WO2.9(s)+0.18H2(g)![]() WO2.72(s)+0.18H2O(g) K2
WO2.72(s)+0.18H2O(g) K2
③WO2.72(s)+0.72H2(g)![]() WO2(s)+0.72H2O(g) K3
WO2(s)+0.72H2O(g) K3
④WO2(s)+2H2(g)![]() W(s)+2H2O(g) K4
W(s)+2H2O(g) K4
则该温度下,①+②+③+④可得WO3(s)+3H2(g)![]() W(s)+3H2O(g),所以K= K1K2K3K4;故答案为:K1K2K3K4;
W(s)+3H2O(g),所以K= K1K2K3K4;故答案为:K1K2K3K4;
(2)①a.反应速率ν(H2)、ν(H2O)都是指正反应,ν(H2)=ν(H2O)不一定平衡,故a错误; b.每断裂3molH-H键的同时断裂3molO-H键,正逆反应速率比不等于系数比,不一定平衡,故b错误; c.焓变与反应方程式的系数有关,反应热不变,不一定平衡,故c错误; d.反应前后气体质量是变量、气体物质的量不变,根据![]() ,密度是变量,混合气体的密度不再改变一定平衡,故d正确; e.反应前后气体物质的量不变,压强是恒量,体系的压强不再改变不一定平衡,故e错误。故答案为:d;
,密度是变量,混合气体的密度不再改变一定平衡,故d正确; e.反应前后气体物质的量不变,压强是恒量,体系的压强不再改变不一定平衡,故e错误。故答案为:d;
②反应在2min时达到平衡,由坐标图可知 ![]() ,
,
WO3(s)+3H2(g)![]() W(s)+3H2O(g)
W(s)+3H2O(g)
始 4 0
转 x x
平 4-x x
![]() ,x=2.5;H2的平衡转化率a=
,x=2.5;H2的平衡转化率a=![]() ;故答案为:62.5;
;故答案为:62.5;
③若在4min时升高并维持温度为T2℃,![]() 增大,说明平衡逆向移动,则该反应的△H<0;反应前后气体物质的量不变,若在8min时缩小容器容积,平衡不移动,所以
增大,说明平衡逆向移动,则该反应的△H<0;反应前后气体物质的量不变,若在8min时缩小容器容积,平衡不移动,所以![]() =1.3。故答案为:< 、=;
=1.3。故答案为:< 、=;
(3)阳极碳化钨失电子发生氧化反应生成钨酸和二氧化碳,阳极反应式是WC+6H2O-10e-=H2WO4↓+CO2↑+10H+,故答案为:WC+6H2O-10e-=H2WO4↓+CO2↑+10H+。

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据_______现象,判断溶液中存在Ag+,可产生Fe3+。
③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
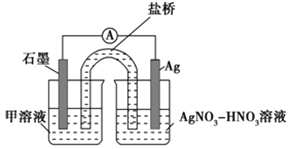
实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。