题目内容
【题目】有A、B、C、D、E五种短周期元素,其原子序数依次增大,在周期表中A的原子半径最小,B的主族序数是周期序数的2倍,D是地壳中含量最多的元素,在周期表中A和E同主族,回答下列问题:
(1)化合物BD2的电子式是_______。
(2)化合物CA3的结构式为______。
(3)C的最低价氢化物与C的最高价氧化物的水化物反应生成盐的化学式为____。
(4)用电子式表示化合物A2D的形成过程:____________。
(5)将物质的量比为1:1的CO2和H2O组成的混合气通入到a mol的过量固体E2D2中,将反应后的固体混合物加入到500mL1mol·L-1盐酸中,则产生无色混合气体的体积在标准状况下为bL,反应后溶液呈中性,则a=____,b=___。
【答案】![]()
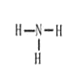 NH4NO3
NH4NO3 ![]() 0.25 2.8
0.25 2.8
【解析】
A为元素周期表中原子半径最小的元素,则A为H元素;D是地壳中含量最多的元素,则D是O元素;A、B、C、D、E五种短周期元素原子序数依次增大,B的主族序数是周期序数的2倍,则B是C元素、C是N元素;A和E同主族,则E是Na元素。
(1)化合物BD2为CO2,CO2为共价化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)化合物CA3为NH3,NH3的空间构型为三角锥形,结构式为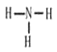 ,故答案为:
,故答案为: ;
;
(3)C是N元素,N元素的最低价氢化物为NH3,最高价氧化物的水化物为HNO3,NH3与HNO3反应生成NH4NO3,故答案为:NH4NO3;
(4)A2D为H2O,用电子式表示H2O的形成过程为![]() ,故答案为:
,故答案为:![]() ;
;
(5)E2D2为Na2O2,由题意可知,CO2和H2O组成的混合气与过量Na2O2反应得到的碳酸钠、氢氧化钠和过氧化钠的固体混合物,加入到500mL1mol·L-1盐酸中,碳酸氢钠、过氧化钠与盐酸反应生成标准状况下bL二氧化碳和氧气的无色混合气体,反应后溶液呈中性说明盐酸与固体混合物恰好完全反应得到氯化钠溶液,由电荷守恒和钠原子个数守恒可知,2n(Na2O2)=n(NaCl)=n(HCl)=0.5mol,则a=0.25mol;设CO2和H2O均为xmol,xmolCO2与xmol Na2O2反应生成xmol Na2CO3,xmolH2O与xmol Na2O2反应生成2xmol NaOH,xmolNa2CO3与盐酸反应生成xmol CO2,(a—2x)mol Na2O2与盐酸反应生成![]() molO2,则b=[xmol+
molO2,则b=[xmol+![]() ]mol×22.4L/mol=11.2aL=2.8L,故答案为:0.25;2.8。
]mol×22.4L/mol=11.2aL=2.8L,故答案为:0.25;2.8。

 名校课堂系列答案
名校课堂系列答案