题目内容
【题目】(1)8.5g氢氧根离子含有的电子数目为_______。
(2)3.1gNa2X含有Na0.1mol,则Na2X的摩尔质量为______,X的相对原子质量为_______。
(3)若1gCO2中含有x个原子,则阿伏加德罗常数可表示为_______。
(4)由硫酸钾、 硫酸铁和硫酸组成的混合溶液,其中c(H)0.1mol/L,c(Fe3)0.3mol/L,c(SO42)0.6mol/L,则c(K)为_______。
(5)相同物质的质量浓度的氯化钠、氯化镁、氯化铝溶液,分别与硝酸银溶液反应,当生成沉淀的质量之比为3:2:1时,消耗三种盐溶液的体积比为_______。
【答案】5NA 或3.011024 62g/mol 16 ![]() mol﹣1 0.2mol/L 9:3:1
mol﹣1 0.2mol/L 9:3:1
【解析】
(1)氢氧根离子含有10个电子,根据n=![]() =
=![]() 计算;
计算;
(2)根据n(Na2X)=![]() n(Na+)计算出Na2X的物质的量,然后结合M=
n(Na+)计算出Na2X的物质的量,然后结合M=![]() 计算其摩尔质量,结合摩尔质量计算X的相对原子质量;
计算其摩尔质量,结合摩尔质量计算X的相对原子质量;
(3)根据n=![]() 计算二氧化碳物质的量,含有原子物质的量为二氧化碳的3倍,再根据N=nNA计算阿伏加德罗常数;
计算二氧化碳物质的量,含有原子物质的量为二氧化碳的3倍,再根据N=nNA计算阿伏加德罗常数;
(4)根据电荷守恒可知:c(K+)+c(H+)+3c(Fe3+)=2c(SO42﹣),据此计算c(K+);
(5)均发生Ag++Cl﹣=AgCl↓,设NaCl、MgCl2、AlCl3与硝酸银溶液反应生成AgCl的物质的量分别为3mol、2mol、1mol,根据氯离子守恒计算NaCl、MgCl2、AlCl3的物质的量,再根据V=![]() 可知,溶液浓度相等,体积相同之比等于物质的量之比。
可知,溶液浓度相等,体积相同之比等于物质的量之比。
(1)8.5g氢氧根离子的物质的量为:![]() =0.5mol,含有电子的物质的量为:0.5mol×10=5mol,含有的电子数为5NA;
=0.5mol,含有电子的物质的量为:0.5mol×10=5mol,含有的电子数为5NA;
(2)n(Na2X)=![]() n(Na+)=0.1mol×
n(Na+)=0.1mol×![]() =0.05mol,M(Na2X)=
=0.05mol,M(Na2X)=![]() =62g/mol,Na2X的相对分子质量为62,X的相对原子质量为:62﹣23×2=16;
=62g/mol,Na2X的相对分子质量为62,X的相对原子质量为:62﹣23×2=16;
(3)1g CO2的物质的量为:![]() =
=![]() mol,含有x个原子,则:
mol,含有x个原子,则:![]() mol×3×NA=x,所以NA=
mol×3×NA=x,所以NA=![]() mol﹣1;
mol﹣1;
(4)根据电荷守恒可知:c(K+)+c(H+)+3c(Fe3+)=2c(SO42﹣),则c(K+)+0.1mol/L+3×0.3mol/L=2×0.6mol/L,解得:c(K+)=0.2mol/L;
(5)相同浓度的NaCl、MgCl2、AlCl3三种溶液分别与硝酸银溶液反应,当生成沉淀的质量之比为3:2:1,设NaCl、MgCl2、AlCl3与硝酸银溶液反应生成AgCl的物质的量分别为3mol、2mol、1mol,根据氯离子守恒,则n(NaCl)=3mol、n(MgCl2)=![]() =1mol、n(AlCl3)=
=1mol、n(AlCl3)=![]() =
=![]() mol,再根据V=
mol,再根据V=![]() 可知,溶液浓度相等,体积相同之比等于物质的量之比,故V(NaCl):V(MgCl2):V(AlCl3)=3mol:1mol:
可知,溶液浓度相等,体积相同之比等于物质的量之比,故V(NaCl):V(MgCl2):V(AlCl3)=3mol:1mol:![]() mol=9:3:1。
mol=9:3:1。

【题目】如表是A、B、C、D四种有机物的有关信息:
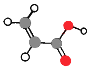
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 ③能与水在一定条件下反应生成有机物C |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③在Cu作催化剂且加热条件下能与O2反应 |
D | ①由C、H、O三种元素组成;②球棍模型为 ③能与C反应生成相对分子质量为100的酯 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是___。
(2)B具有的性质是____(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色。
(3)由B制备硝基苯的化学方程式____。
(4)D与C反应能生成相对分子质量为100的酯,该反应的反应类型为___;其化学方程式为____。