题目内容
【题目】第IIA族元素在地壳内蕴藏较丰富,其单质和化合物用途广泛。回答下列问题:
(1)基态Ca原子M能层有_______个运动状态不同的电子,Mn和Ca属于同一周期,且核外最外层电子构型相同,但金属Mn的熔沸点等都比金属Ca高,原因______。
(2)氯气与熟石灰反应制漂白粉时会生成副产物Ca(ClO3)2,Ca(ClO3)2中的阴离子空间构型是_________,中心原子的杂化方式为_______。
(3)碳酸盐的热分解示意图如下图所示。热分解温度:CaCO3__________(填“高于”或“低于”)SrCO3,原因是_______。从成键轨道看,CO2分子内的化学键类型有________。
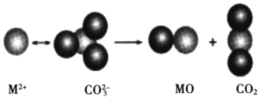
(4)格氏试剂RMgX是镁和卤代烃反应的产物,它在醚的稀溶液中以单体形式存在,在浓溶液中以二聚体存在,二聚体结构如下图所示。请在图中标出二聚体中的配位键__________。
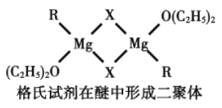
【答案】8 Mn原子半径较小且价电子数较多,金属键较强 三角锥形 sp3 低于 r(Ca2+)<r(Sr2+),CaO晶格能大于SrO晶格能,CaCO3更易分解 σ键、π键 
【解析】
(1)元素有几种电子,其核外电子就有几种运动状态;Mn的原子半径更小、价电子更多;
(2)ClO3-中心原子Cl的孤电子对数=![]() =1,价层电子对数=1+3=4,杂化轨道数目为4,在VSEPR模型基础上忽略孤对电子可得微粒空间构型;
=1,价层电子对数=1+3=4,杂化轨道数目为4,在VSEPR模型基础上忽略孤对电子可得微粒空间构型;
(3)碳酸盐的热分解本质是金属阳离子结合酸根离子中的氧离子,r(Ca2+)<r(Sr2+),CaO晶格能大于SrO晶格能;CO2分子为O=C=O结构,双键中碳原子与氧原子电子云以“头碰头”“肩并肩”形成进行重叠;
(4)含有空轨道的离子和含有孤电子对的原子间易形成配位键,配位键由提供孤电子对的原子指向提供空轨道的离子。
(1)元素有几种电子,其核外电子就有几种运动状态,Ca原子M层有8个电子,所以M层电子有8种运动状态;与Ca相比,Mn的原子半径更小、价电子数更多,Mn中金属键更强,故金属Mn的熔点沸点都比金属Ca高;
(2) ClO3中心原子Cl的孤电子对数=![]() =1,价层电子对数=1+3=4,杂化轨道数目为4,Cl原子采取sp3杂化,微粒的VSEPR模型为四面体形,忽略孤对电子可得微粒空间构型为三角锥形;
=1,价层电子对数=1+3=4,杂化轨道数目为4,Cl原子采取sp3杂化,微粒的VSEPR模型为四面体形,忽略孤对电子可得微粒空间构型为三角锥形;
(3)碳酸盐的热分解本质是金属阳离子结合酸根离子中的氧离子,r(Ca2+)<r(Sr2+),CaO晶格能大于SrO晶格能,CaCO3更易分解,即碳酸钙的热分解温度低于碳酸锶;CO2分子为O=C=O结构,双键中碳原子与氧原子电子云以“头碰头”“肩并肩”形成进行重叠,含有σ键、π键;
(4)配位键是由孤对电子与空对轨道形成的,Mg最外层有两个电子,可以与R、X形成离子键,而O原子中存在孤对电子,所以两个O(C2H5)2可以与Mg形成配位键,在二聚体中,同理,一个Mg与R、X相连,则另外一个X和O(C2H5)2则与Mg形成配位键,如图所示: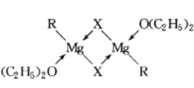 。
。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案