题目内容
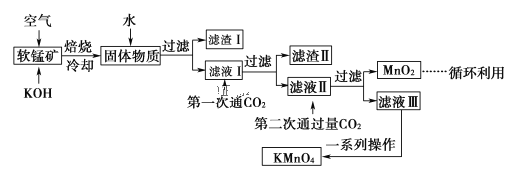
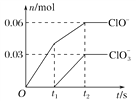
【题目】化学反应的快慢和限度对人类生产生活有重要的影响。800℃时,A、B、C三种气体在恒容密闭容器中反应时的浓度变化如图所示,回答下列问题:

(1)该反应的生成物是________。
(2)2min内,C的反应速率为________。
(3)该反应的化学方程式为________。
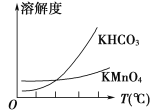
(4)在其他条件下,测得A的反应速率为![]() ,此时的反应速率与800℃时相比_____。
,此时的反应速率与800℃时相比_____。
A.比800℃时慢 B.比800℃时快 C.和800℃时速率一样
【答案】B和C ![]()
![]() B
B
【解析】
(1)由图象可知,A的物质的量浓度减小,B和C的物质的量浓度增加,则A为反应物,B和C为生成物,故答案为:B和C。
(2)![]() ,故答案为:
,故答案为:![]() 。
。
(3)恒容条件下,反应中各物质的浓度变化量之比等于化学方程式中对应物质的化学计量数之比,![]() ,则反应的化学方程式为
,则反应的化学方程式为![]() ,故答案为:
,故答案为:![]() 。
。
(4)800℃时,![]() ,选B,故答案为:B。
,选B,故答案为:B。

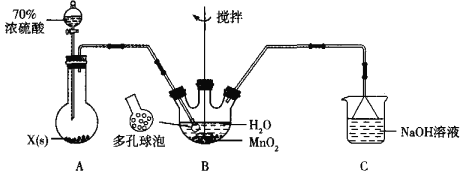
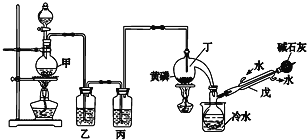
【题目】如图是某化学兴趣小组制备PCl3的实验装置(部分仪器已省略):
有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 其他 | |
黄磷 | 44.1 | 280.5 | 2P(过量)+3Cl2 |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
请回答下列问题:
(1)仪器戊的名称为___。
(2)实验时甲中所发生反应的化学方程式为___。
(3)乙中盛放的试剂是___,其作用是___;丙中盛放的试剂是___,其作用是___。
(4)向仪器丁中通入干燥、纯净的Cl2之前,应先通入一段时间的CO2,其目的主要是___。
(5)碱石灰的作用是___(答出一条即可)。
(6)PCl3粗产品中常含有POCl3、PCl5等,加入黄磷(化学式用P表示)经加热除去PCl5的化学反应方程式为___,后通过___(填实验操作名称),即可得到PCl3纯品。
【题目】对工业废气进行脱硝有多种方法。
(1)用活性炭还原法处理氮氧化物的反应为C(s)+2NO(g)![]() N2(g)+CO2(g)。一定条件下按下表所示条件向体积固定的容器中充入物质发生该反应。
N2(g)+CO2(g)。一定条件下按下表所示条件向体积固定的容器中充入物质发生该反应。
容器 | 温度 | 体积 | C(s) | NO(g) | N2(g) | CO2(g) |
甲 | 600℃ | V L | 1mol | 2mol | 0 | 0 |
乙 | 600℃ | V L | 0 | 0 | 2mol | 2mol |
①下列能说明甲容器中反应达到平衡状态的是_______。
a.容器的压强保持不变 b.v(NO)正=2v(CO2)逆
c.混合气体的密度保持不变 d.NO、N2、CO2的物质的量之比为2∶1∶1
②关于平衡时的甲、乙两容器,下列说法一定正确的是_______。
a.p(甲)=p(乙) b.c(NO)甲=c(CO2)乙
c.2c(CO2)甲=c(N2)乙 d.体积分数φ(CO2)甲=φ(N2)乙
(2)氮氧化物与悬浮在大气中的海盐粒子相互作用生成亚硝酰氯(ClNO),涉及反应如下:4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1 ;2NO2(g)+NaCl(s)
2NaNO3(s)+2NO(g)+Cl2(g) K1 ;2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2;2NO(g)+Cl2(g)
NaNO3(s)+ClNO(g) K2;2NO(g)+Cl2(g)![]() 2ClNO(g) K3;则K1、K2 、K3之间的关系为K3=_______
2ClNO(g) K3;则K1、K2 、K3之间的关系为K3=_______
(3)利用O3进行如下脱硝反应:2NO2(g)+O3(g)![]() N2O5(g)+O2(g) ΔH<0。其他条件一定时,NO2(g)的平衡转化率随温度和压强的变化情况如下图甲所示。X表示_______(填“压强”或“温度”),L1_______L2(填“<”或“>”)。
N2O5(g)+O2(g) ΔH<0。其他条件一定时,NO2(g)的平衡转化率随温度和压强的变化情况如下图甲所示。X表示_______(填“压强”或“温度”),L1_______L2(填“<”或“>”)。
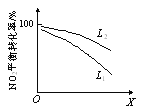
(4)用稀硝酸吸收NOx进行脱硝,得到HNO3和HNO2(弱酸)的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:_______。