题目内容
在一个固定体积的密闭容器中,加入2mol A和1mol B发生反应:2A(g)+B(g) 3C(g)+D(g),达到平衡时,C的浓度为W mol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是
3C(g)+D(g),达到平衡时,C的浓度为W mol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是
| A.4molA+2molB | B.2molA+1molB+3molC+1molD |
| C.3molC+1molD+1molB | D.3molC+1molD |
D
解析试题分析:这是等温等容条件下的反应前后分子数改变的等效平衡,只要是按照化学计量数的比转化为同一半边的物质时,各物质的数值相等,即可,因此只能选B。
考点:等效平衡的有关知识。

已建立化学平衡的某可逆反应X(g)+2Y(g)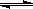 2Z(g),当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是
2Z(g),当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是
①生成物的质量分数一定增加,②生成物总量一定增加, ③反应物的转化率一定增大,
④反应物的浓度一定降低,⑤正反应速率一定大于逆反应速率,⑥一定使用催化剂
| A.①②③ | B.③④⑤ | C.②⑤ | D.④⑥ |
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)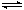 CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是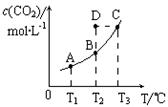
A.反应CO(g)+H2O(g)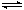 CO2(g)+H2(g)的△H>0 CO2(g)+H2(g)的△H>0 |
| B.在T2时,若反应进行到状态D,则一定有v正<v逆 |
| C.平衡状态A与C相比,平衡状态A的c(CO)小 |
| D.由D状态转变为C状态后,混合气体的平均相对分子质量不变 |
下列各组Na2S2O3溶液跟稀H2SO4反应的实验中,溶液中最先变浑浊的是
| 选项 | 反应 温度 | 反 应 物 | H2O | |||
| Na2S2O3 | H2SO4 | |||||
| t(℃) | V(mL) | c(mol×L-1) | V(mL) | c(mol×L-1) | V(mL) | |
| A | 10 | 5 | 0.1 | 10 | 0.1 | 10 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 30 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 35 |
汽车尾气中的有毒气体NO和CO,在一定条件下可发生反应生成N2和CO2。下列关于此反应的说法中,正确的是( )
| A.减小压强能增大反应速率 |
| B.增大压强能减小反应速率 |
| C.使用适当的催化剂能增大反应速率 |
| D.升高温度对反应速率无影响 |
已知反应:2SO2(g)+O2(g)  2SO3(g);ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g);ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是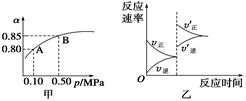
| A.由图甲知,A点SO2的平衡浓度为0.4 mol/L |
| B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2 |
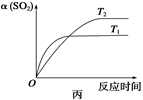
| C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
| D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)  Y(g)+Z(s),以下能说明反应达到平衡标志的是( )
Y(g)+Z(s),以下能说明反应达到平衡标志的是( )
| A.混合气体的压强不再变化 |
| B.X、Y、Z的物质的量之比为2:1:1 |
| C.单位时间内生成lmolY的同时分解2mol X |
| D.X的分解速率与Y的消耗速率相等 |
一定条件下,在固定容积密闭容器中发生可逆反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是
| A.达到化学平衡时,化学反应速率的关系是2v逆(NH3)=3v正 (H2O) |
| B.达到化学平衡时,NH3、O2、NO、H2O物质的量之比为4∶5∶4∶6 |
| C.混合气体的密度一定时,该化学反应达到化学平衡 |
| D.若单位时间内生成x mol NO的同时,生成x mol NH3,则反应达到平衡状态 |
在密闭容中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.A的转化率增大 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a < c+d |