题目内容
在密闭容中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.A的转化率增大 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a < c+d |
D
解析试题分析:将气体体积压缩到原来的一半,若平衡不移动,各物质的浓度将变为原来的2倍,而实际D的浓度为原平衡的1.8倍,说明D的物质的量减小,C项错误;平衡向逆反应方向移动,A项、B项错误;逆反应方向为气体系数减小的方向,D项正确。
考点:本题考查根据化学平衡移动判断条件的变化。

在一个固定体积的密闭容器中,加入2mol A和1mol B发生反应:2A(g)+B(g) 3C(g)+D(g),达到平衡时,C的浓度为W mol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是
3C(g)+D(g),达到平衡时,C的浓度为W mol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是
| A.4molA+2molB | B.2molA+1molB+3molC+1molD |
| C.3molC+1molD+1molB | D.3molC+1molD |
一定温度下,可逆反应 A2(g)+3B2(g) 2AB3(g) 达到平衡的标志是
2AB3(g) 达到平衡的标志是
| A.容器内每减少1mol A2,同时生成2mol AB3 |
| B.容器内每减少1mol A2,同时生成3mol B2 |
| C.容器内A2、B2、AB3的物质的量之比为1:3:2 |
| D.容器内A2、B2、AB3的物质的量浓度相等 |
对于可逆反应mA(g)+nB(g) pC(g)+gD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到两种υ-t图象如下图。则如下关系正确的为
pC(g)+gD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到两种υ-t图象如下图。则如下关系正确的为
①a1=a2;②a1<a2;③b1=b2;④b1<b2;⑤t1>t2;⑥t1=t2;⑦两图中阴影部分面积相等;⑧右图阴影部分面积更大
| A.②④⑤⑦ | B.②④⑥⑧ | C.②③⑤⑦ | D.②③⑥⑤ |
一定条件下,C0与H2反应可生成乙醇:2CO+4H2? CH3CH20H+H20。下列关于该反应的说法错误的是
| A.增大CO的浓度能减小反应速率 |
| B.升高体系温度能增大反应速率 |
| C.使用合适的催化剂可增大反应速率 |
| D.若反应在密闭容器中进行,H2和C0不能全部转化为产物 |
在一密闭恒容容器中发生如下反应:aX(g)+bY(g) cZ(g) ΔH>0,达平衡后,当其他条件不变时,下列说法正确的是
cZ(g) ΔH>0,达平衡后,当其他条件不变时,下列说法正确的是
| A.升高温度,正反应速率增大,逆反应速率减小, 平衡常数增大 |
| B.若通入稀有气体平衡不移动,则a+b=c |
| C.若加入催化剂,反应速率改变,但平衡不移动 |
| D.若增加X的量,平衡正向移动,X的转化率增大 |
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
| A.增加压强 | B.降低温度 | C.增大CO的浓度 | D.更换催化剂 |
在密闭容器中进行反应:2A(g)+B(g) 3C(g)+Q(Q>0)。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
3C(g)+Q(Q>0)。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是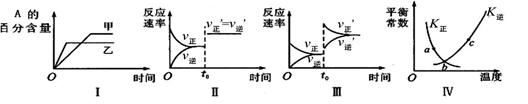
| A.图I表示温度对化学平衡的影响,且甲的温度较高 |
| B.图Ⅱ表示t0时刻缩小容器体积对反应速率的影响 |
| C.图Ⅲ表示t0时刻增大B浓度对反应速率的影响 |
| D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态 |
在容积均为500 mL的I、Ⅱ、Ⅲ三个密闭容器中分别充入l molN2和2.5 molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下发生反应N2(g)+3H2(g)2NH3(g) H<O。实验测得反应均进行到t min时N2的体积分数如图所示。下列说法正确的是
H<O。实验测得反应均进行到t min时N2的体积分数如图所示。下列说法正确的是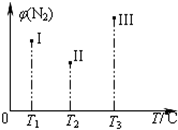
| A.当z,v(H2)=3v(N2)时,可以说明三个容器中的反应达平衡状态 |
| B.在t min时,一定达化学平衡状态的是Ⅱ和Ⅲ |
| C.在t min时,一定没有达化学平衡状态的是I |
| D.三个容器中的反应均达到平衡后,容器I中混合气体的平均相对分子质量最小 |