题目内容
【题目】李克强总理在《2018年国务院政府工作报告》中强调“今年二氧化硫、氮氧化物排放量要下降3%。”研究烟气的脱硝(除NOx)、脱硫(除SO2)有着积极的环保意义。
Ⅰ. 汽车排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。
2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。
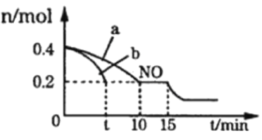
(1)图中a、b分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (NO)的变化曲线,其中表示催化剂表面积较大的曲线是______(填“a”或“b”)
(2)在a曲线所示反应中,0~10min内,CO的平均反应速率v(CO)=___________;T℃时,该反应的化学平衡常数K=_____________;平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将_________移动(填“向左”、“向右”或“不”)
(3)15min时, n (NO)发生图中所示变化,则改变的条件可能是_______(填序号)
A.充入少量CO B.将N2液化移出体系 C.升高温度 D.加入催化剂
Ⅱ. 已知有下列反应:
①5O2(g)+ 4NH3(g)![]() 6H2O(g)+ 4NO(g) △H1
6H2O(g)+ 4NO(g) △H1
②N2(g)+O2(g)![]() 2NO(g) △H2
2NO(g) △H2
③2NO(g)+ O2(g)![]() 2NO2(g) △H3
2NO2(g) △H3
(1)若在高效催化剂作用下可发生8NH3(g)+ 6NO2(g)![]() 7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=__________(用△H1,△H2,△H3表示),△S______0
7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=__________(用△H1,△H2,△H3表示),△S______0
(2)某温度下,向某恒容密闭容器中充入一定量的NH3和NO2,按照(1)的原理模拟污染物的处理。若容器中观察到________________(填序号),可判断该反应达到平衡状态
A.混合气体颜色不再改变 B. 混合气体的密度不再改变
C.混合气体摩尔质量不再改变 D. NH3和NO2的物质的量之比不再改变
(3)将一定比例的O2、NH3和NO2的混合气体,匀速通入图(a)所示装有催化剂M的反应器中充分进行反应。
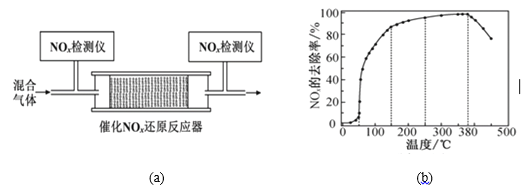
反应相同时间NOx的去除率随反应温度的变化曲线如图(b)所示。已知该催化剂在100~150℃时活性最高,那么在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢,其中去除率迅速上升段的主要原因是____________________________;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________________
【答案】b0.01mol/(L·min)5 L/mol不AB2△H1-7△H2-3△H3>AC温度升高和催化剂的高活性共同作用使得反应速率加快,去除率先迅速上升催化剂失活或者副反应程度的增大(氨气和氧气反应)
【解析】
I.(1)利用表面积增大,加快反应速率;(2)根据化学反应速率的数学表达式、化学平衡常数的定义、化学平衡常数与浓度商的关系进行分析;(3)从影响化学平衡移动因素进行分析;II.(1)根据热化学反应方程式的计算进行分析;(2)考查化学平衡状态的判断;(3)从化学反应条件的控制。
I.(1)表面积大,增加接触面积,加快反应速率,因此催化剂面积较大的曲线是b;(2)根据化学反应速率的数学表达式,v(CO)=(0.4-0.2)/(2×10)mol/(L·min)=0.01 mol/(L·min);
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
起始浓度: 0.2 0.2 0 0
变化浓度: 0.1 0.1 0.1 0.05
平衡浓度: 0.1 0.1 0.1 0.05,根据平衡常数的表达式,![]() =5;此时CO的浓度为0.2mol·L-1,CO2的浓度为0.2mol·L-1,代数上式,此时的浓度商为5,与化学平衡常数相等,即平衡不移动;(3)15min时,NO的物质的量减少,A、充入少量CO,增加反应物的浓度,平衡向正反应方向进行,NO的物质的量减少,故A错误;B、将N2移出,减少生成物浓度,平衡向正反应方向移动,NO的物质的量减小,故B正确;C、此反应是放热反应,升高温度,平衡向逆反应方向进行,NO物质的量增加,故C错误;D、加入催化剂,平衡不移动,NO物质的量不变,故D错误;II.(1) 根据目标反应方程式,①×2-②×7-3×③,即△H=2△H1-7△H2-3△H3;生成物气体系数之和大于反应物气体系数之和,即此反应为熵增,△S>0;(2)A、NO2为红棕色气体,其余气体为无色,即当气体颜色不再改变,说明反应达到平衡,故A正确;B、是恒容状态,气体体积保持不变,组分都是气体,气体质量不再改变,因此密度始终保持不变,即密度不再改变,不能说明反应达到平衡,故B错误;C、反应前后气体系数之和不相等,即物质的量改变,组分都是气体,气体质量保持不变,根据M=m/n,因此平均摩尔质量不再改变,说明反应达到平衡,故C正确;D、氨气和NO2物质的量之比始终保持不变,因此不能作为达到平衡的标志,故D错误;(3)随着温度的升高,去除率迅速上升,主要原因是温度升高和催化剂的高活性共同作用使得反应速率加快,去除率先迅速上升;高于380℃,去除率迅速下降的原因是催化剂失活或者副反应程度的增大(氨气和氧气反应)。
=5;此时CO的浓度为0.2mol·L-1,CO2的浓度为0.2mol·L-1,代数上式,此时的浓度商为5,与化学平衡常数相等,即平衡不移动;(3)15min时,NO的物质的量减少,A、充入少量CO,增加反应物的浓度,平衡向正反应方向进行,NO的物质的量减少,故A错误;B、将N2移出,减少生成物浓度,平衡向正反应方向移动,NO的物质的量减小,故B正确;C、此反应是放热反应,升高温度,平衡向逆反应方向进行,NO物质的量增加,故C错误;D、加入催化剂,平衡不移动,NO物质的量不变,故D错误;II.(1) 根据目标反应方程式,①×2-②×7-3×③,即△H=2△H1-7△H2-3△H3;生成物气体系数之和大于反应物气体系数之和,即此反应为熵增,△S>0;(2)A、NO2为红棕色气体,其余气体为无色,即当气体颜色不再改变,说明反应达到平衡,故A正确;B、是恒容状态,气体体积保持不变,组分都是气体,气体质量不再改变,因此密度始终保持不变,即密度不再改变,不能说明反应达到平衡,故B错误;C、反应前后气体系数之和不相等,即物质的量改变,组分都是气体,气体质量保持不变,根据M=m/n,因此平均摩尔质量不再改变,说明反应达到平衡,故C正确;D、氨气和NO2物质的量之比始终保持不变,因此不能作为达到平衡的标志,故D错误;(3)随着温度的升高,去除率迅速上升,主要原因是温度升高和催化剂的高活性共同作用使得反应速率加快,去除率先迅速上升;高于380℃,去除率迅速下降的原因是催化剂失活或者副反应程度的增大(氨气和氧气反应)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知1L某待测液中除含有0.2mol·L-1的Na+外,还可能含有下列离子中的一种或几种:
阳离子 | K+、NH4+、Mg2+、Ba2+、 Fe3+ |
阴离子 | Cl-、Br-、CO32-、HCO3-、SO42- |
现进行如下实验操作(每次实验所加试剂均过量):

(1)由气体B可确定待测液中含有的离子是______________。
(2)由沉淀D和沉淀E可以判断待测液中一定含有______离子,据此可以排除的离子是________。
(3)由白色沉淀B可确定待测液中含有的离子是__________________。
(4)某同学读图后,认为待测液一定不含溴离子,他判断的依据是_________________。
(5)综合分析,待测液中K+的最小浓度为____________________。
【题目】下列实验操作、实验现象和实验结论均正确的是( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 将Al2(SO4)3溶液和NaHCO3溶液混合 | 产生白色沉淀,并有大量气体生成 | 生成Al2(CO3)3沉淀和CO2气体 |
B | 在淀粉溶液中加入几滴稀硫酸,水浴5min,加入NaOH溶液调溶液pH至碱性,再加入新制的Cu(OH)2悬浊液,加热 | 有红色沉淀生成 | 淀粉完全水解 |
C | 将少量SO2气体通过足量Na2O2 | 余下气体能使带火星木条复燃 | 有O2生成 |
D | 用pH试纸分别测定等浓度的A、B两溶液(可能为NaHCO3或者Na2CO3)的pH值 | pHA> pHB | A溶液为Na2CO3溶液 |
A. A B. B C. C D. D
