题目内容
【题目】下列叙述正确的是( )
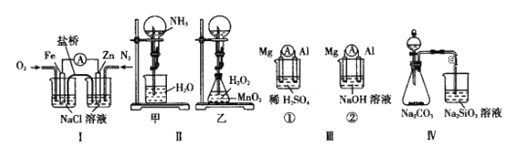
A.图I装置中通入N2和O2的作用是相同的
B.图II中甲、乙两装置产生喷泉的原理一样
C.图III①装置中镁片是原电池的负极,②装置镁片是原电池的正极
D.图IV分液漏斗中盛硝酸能证明非金属性:N>C>Si,盛硫酸能证明非金属性:S>C>Si
【答案】C
【解析】
A.图I装置为Zn-Fe原电池,发生的是Zn的吸氧腐蚀,所以通入O2在正极发生还原反应,而通入的N2在负极不反应,起到加快反应速率的作用,A错误;
B.图Ⅱ中甲、乙两装置产生喷泉的原理不一样,甲利用的是氨气的极易溶于水,烧瓶内压强低于大气压强,乙利用的是双氧水易分解产生氧气使锥形瓶内压强增大,把锥形瓶内的溶液压入圆底烧瓶中,B错误;
C.图Ⅲ①装置中Mg-Al构成原电池,二者都能与硫酸反应,由于镁比铝更活泼,所以镁片是原电池的负极;②装置中Mg-Al构成原电池,但能与氢氧化钠溶液反应的是铝,所以镁片是原电池的正极,C正确;
D.图Ⅳ分液漏斗盛硝酸不能证明非金属性N>C>Si,因为硝酸是挥发性的酸,中间若没有除杂装置,容易对实验产生干扰,所以D错误;
故选C。

练习册系列答案
相关题目