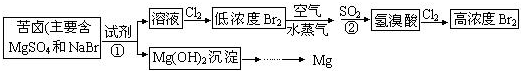
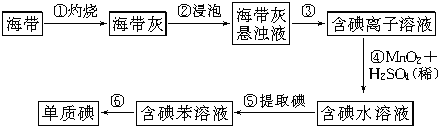
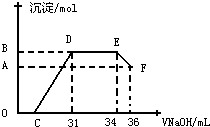
题目内容
海水是巨大的化学资源库,下列有关海水综合利用说法正确的是( )
| A.海水的淡化,只需经过化学变化就可以得到 |
| B.海水蒸发制海盐的过程中只发生了化学变化 |
| C.从海水中可以得到NaCl,电解熔融NaCl可制备金属Na |
| D.利用海水、铝、空气的航标灯的原理是将电能转化为化学能 |
A、海水淡化主要是通过物理方法分离得到,故A错误;
B、海水晒盐是利用氯化钠溶解度随温度变化不大,溶蒸发溶质析出,过程中无化学变化,故B错误;
C、从海水中可以得到NaCl晶体,电解熔融氯化钠得到金属钠,是工业制备钠的方法,故C正确;
D、海水、铝、空气可以形成原电池反应提供电能,航标灯的原理是将化学能转化为电能,故D错误;
故选C.
B、海水晒盐是利用氯化钠溶解度随温度变化不大,溶蒸发溶质析出,过程中无化学变化,故B错误;
C、从海水中可以得到NaCl晶体,电解熔融氯化钠得到金属钠,是工业制备钠的方法,故C正确;
D、海水、铝、空气可以形成原电池反应提供电能,航标灯的原理是将化学能转化为电能,故D错误;
故选C.

练习册系列答案
相关题目