题目内容
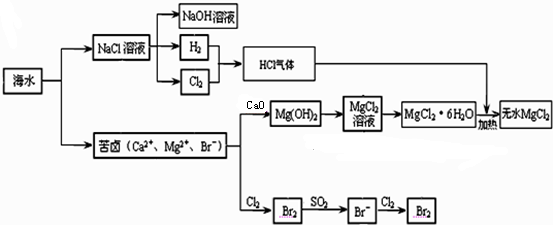
海水是化学元素的宝库,从海水中可以提取或生产多种化工原料,如食盐、氯气、单质溴、镁、纯碱等,它们在工农业生产中有着广泛的用途.根据学过的知识回答下列问题:
(1)某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液.
①其反应原理为:(用离子方程式表示)______.
②配制250mL4.0mol?L-1NaOH溶液,需要用到的玻璃仪器,除烧杯、玻璃棒外,还必须用到的是______.
(2)工业制得粗硅后,再与氯气等物质发生反应,最终得到纯硅.请写出工业制取粗硅的化学方程式:______
(3)金属镁被誉为“国防金属”,若镁起火,不能用CO2来灭火,其原因可用化学方程式表示为______
(4)①若Na2CO3固体中混有少量NaHCO3杂质,除去杂质的方法是______,
②若NaHCO3溶液中混有少量Na2CO3杂质,除去杂质的方法是______.
(1)某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液.
①其反应原理为:(用离子方程式表示)______.
②配制250mL4.0mol?L-1NaOH溶液,需要用到的玻璃仪器,除烧杯、玻璃棒外,还必须用到的是______.
(2)工业制得粗硅后,再与氯气等物质发生反应,最终得到纯硅.请写出工业制取粗硅的化学方程式:______
(3)金属镁被誉为“国防金属”,若镁起火,不能用CO2来灭火,其原因可用化学方程式表示为______
(4)①若Na2CO3固体中混有少量NaHCO3杂质,除去杂质的方法是______,
②若NaHCO3溶液中混有少量Na2CO3杂质,除去杂质的方法是______.
(1)①氯气和氢氧化钠制取简易消毒液得到次氯酸钠溶液,反应的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O;
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
②配制溶液步骤分析,应先计算所需氢氧化钠溶液体积,用量筒量取氢氧化钠溶液,在烧杯中溶解冷却后沿玻璃棒注入250ml容量瓶,最后用胶头滴管定容需要用到的玻璃仪器,除烧杯、玻璃棒外,还必须用到的是,250mL容量瓶,胶头滴管;
故答案为:250mL容量瓶,胶头滴管;
(2)工业制备粗硅是利用二氧化硅和碳高温加热反应得到粗硅,反应的化学方程式为:SiO2+2C
Si+2CO;
故答案为:SiO2+2C
Si+2CO;
(3)镁在二氧化碳气体中燃烧生成氧化镁和碳;反应的化学方程式为:2Mg+CO2
2MgO+C;
故答案为:2Mg+CO2
2MgO+C;
(4)①Na2CO3固体中混有少量NaHCO3杂质,利用碳酸氢钠受热分解除杂,2NaHCO3
Na2CO3+CO2↑+H2O;
故答案为:加热;
②NaHCO3溶液中混有少量Na2CO3杂质,可以通入二氧化碳气体和碳酸钠反应生成碳酸氢钠除去,Na2CO3+CO2+H2O=2NaHCO3;
故答案为:通入过量CO2.
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
②配制溶液步骤分析,应先计算所需氢氧化钠溶液体积,用量筒量取氢氧化钠溶液,在烧杯中溶解冷却后沿玻璃棒注入250ml容量瓶,最后用胶头滴管定容需要用到的玻璃仪器,除烧杯、玻璃棒外,还必须用到的是,250mL容量瓶,胶头滴管;
故答案为:250mL容量瓶,胶头滴管;
(2)工业制备粗硅是利用二氧化硅和碳高温加热反应得到粗硅,反应的化学方程式为:SiO2+2C
| ||
故答案为:SiO2+2C
| ||
(3)镁在二氧化碳气体中燃烧生成氧化镁和碳;反应的化学方程式为:2Mg+CO2
| ||
故答案为:2Mg+CO2
| ||
(4)①Na2CO3固体中混有少量NaHCO3杂质,利用碳酸氢钠受热分解除杂,2NaHCO3
| ||
故答案为:加热;
②NaHCO3溶液中混有少量Na2CO3杂质,可以通入二氧化碳气体和碳酸钠反应生成碳酸氢钠除去,Na2CO3+CO2+H2O=2NaHCO3;
故答案为:通入过量CO2.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
 →CO(NH2)2
→CO(NH2)2