题目内容
【题目】根据下图所示的N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况,判断下列说法正确的是
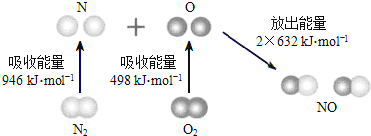
A.N2(g)与O2(g)反应生成NO(g)是放热反应
B.2molO原子结合生成O2(g)时需要放出498kJ能量
C.1molNO(g)分子中的化学键断裂时需要放出632kJ能量
D.N2(g)+O2(g)=2NO(g)△H=+1444kJ/mol.
【答案】B
【解析】
试题分析:焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,反应N2+O2═2NO的反应热△H=946kJ/mol+498kJ/mol-2×632kJ/mol=+180kJ/mol,反应是吸热反应;A、依据计算分析反应是吸热反应,A错误;B、原子结合形成分子的过程是化学键形成过程,是放热过程,2mol O原子结合生成O2(g)时需要放出498kJ能量,B正确;C、形成2molNO放热2×632×J能量,所以1mol NO(g)分子中的化学键断裂时需要吸收632kJ能量,C错误;D、根据A中分析可知N2+O2=2NO△H=+180kJ/mol,D错误;答案选B。

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
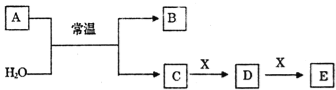
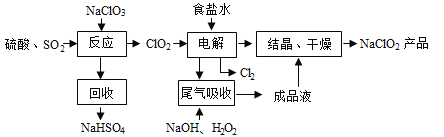
【题目】为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
![]()
(1)判断BaCl2已过量的方法是 。
(2)第④步中,相关的化学方程式是 。
(3)配制NaCl溶液时,若出现下列操作,其结果偏高还是偏低?
A.称量时NaCl已潮解( ) |
B.天平的砝码已锈蚀( ) |
C.定容摇匀时,液面下降又加水( ) |
D.定容时俯视刻度线( ) |