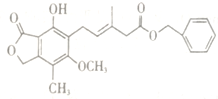
题目内容
【题目】现有①SO2②SO3③SO32-④SO42-四种粒子,回答下列问题:
(1)其中中心原子S的杂化方式为sp2的是__(填序号,下同);中心原子S的杂化方式为sp3的是_________.
(2)SO2在水中的溶解度比较大,原因是_____________。
(3)下列对H2SO3和H2SO4的说法正确的是_____(填字母)。
A.H2SO4比H2SO3易电离出H+是因为H2SO4分子中的非羟基氧多
B.H2SO4比H2SO3易电离出H+是因为H2SO4分子中中心原子S的孤电子对少
C.在H2SO4溶液中存在的粒子的空间构型有V形和正四面体形
(4)若丁二烯CH2=CH-CH=CH2中除含σ键外,还含有一个Π44键(Πmn键表示n个原子、m个电子组成的大п键),SO2含有大п键,可表示为___________。
【答案】 ①② ③④ SO2是极性分子,H2O也是极性分子,根据相似相溶原理,SO2在水中的溶解度较大 AC ![]()
【解析】(1)①SO2中S原子的价电子对数为![]() =3,所以杂化类型为sp2;②SO3中S原子的价电子对数为
=3,所以杂化类型为sp2;②SO3中S原子的价电子对数为![]() =3,所以杂化类型为sp2;③SO32-中S原子的价电子对数为
=3,所以杂化类型为sp2;③SO32-中S原子的价电子对数为![]() =4,所以杂化类型为sp3;④SO42-中S原子的价电子对数为
=4,所以杂化类型为sp3;④SO42-中S原子的价电子对数为![]() =4,所以杂化类型为sp3;故①②中心原子S的杂化方式为sp2;③④中心原子S的杂化方式为sp3;(2) SO2是极性分子,H2O也是极性分子,根据相似相溶原理,SO2在水中的溶解度较大;(3)A、同一元素的不同含氧酸中,非羟基氧原子数越大其酸性越强,硫酸分子中的非羟基氧原子数比亚硫酸多,所以H2SO4的酸性大于H2SO3的酸性,选项A正确;B. 硫酸分子中的非羟基氧原子数比亚硫酸多,硫酸中心原子硫价态高,易于电离出H+,而不是中心原子的孤电子对的原因,选项B错误;C、在H2SO4溶液中存在的粒子的空间构型有水为V形和硫酸根离子为正四面体形,选项C正确。答案选AC;(4) SO2中有3个原子,4个电子形成大п键,可表示为
=4,所以杂化类型为sp3;故①②中心原子S的杂化方式为sp2;③④中心原子S的杂化方式为sp3;(2) SO2是极性分子,H2O也是极性分子,根据相似相溶原理,SO2在水中的溶解度较大;(3)A、同一元素的不同含氧酸中,非羟基氧原子数越大其酸性越强,硫酸分子中的非羟基氧原子数比亚硫酸多,所以H2SO4的酸性大于H2SO3的酸性,选项A正确;B. 硫酸分子中的非羟基氧原子数比亚硫酸多,硫酸中心原子硫价态高,易于电离出H+,而不是中心原子的孤电子对的原因,选项B错误;C、在H2SO4溶液中存在的粒子的空间构型有水为V形和硫酸根离子为正四面体形,选项C正确。答案选AC;(4) SO2中有3个原子,4个电子形成大п键,可表示为![]() 。
。