题目内容
1.下列电离方程式正确的是( )| A. | CaCl2=Ca2++Cl2? | B. | Na2SO4=Na++SO42- | ||
| C. | HNO3=H++NO3- | D. | NaHCO3=Na++H++CO32- |
分析 用化学式和离子符号表示电离过程的式子,称为电离方程式.方程式左边写化学式,右边写离子,所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等,离子团不能拆开,强电解质用=连接,弱电解质用?连接.
A.氯原子角标应转化为化学计量数;
B.左右电荷不守恒;
C.硝酸为强酸,完全电离;
D.HCO3-是H2CO3的酸式盐的酸根部分不能拆.
解答 解:A.氯化钙电离出氯离子和钙离子CaCl2=Ca2++2Cl-,故A错误;
B.硫酸钠电离时生成钠离子、硫酸根离子,其电离方程式为Na2SO4=2Na++SO42-,故B错误;
C.硝酸为强酸,完全电离出氢离子和硝酸根离子HNO3=H++NO3-,故C正确;
D.NaHCO3是H2CO3的酸式盐,HCO3-不能拆,电离方程式为:NaHCO3═Na++HCO3-,故D错误;
故选C.
点评 本题考查了电离方程式的书写判断,掌握正确书写电离方程式的方法,并会正确判断电离方程式的正误是解题的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列属于新型无机非金属材料的是( )
| A. | 高强度水泥 | B. | 钢化玻璃 | C. | 碳化硼陶瓷 | D. | 钢铁 |
12.某元素的一种同位素AY,其中子数为N,它与1H原子组成HmY分子,则在b g HmY分子中所含质子的物质的量( )
| A. | ($\frac{b}{A}$)(A-N)mol | B. | ($\frac{b}{A}$)(A-N+m)mol | C. | $\frac{b}{A+m}$(A-N)mol | D. | $\frac{b}{A+m}$(A-N+m)mol |
16.把含有一种氯化物杂质的CaCl2粉末100克,溶于水后,与足量的硝酸银溶液反应生成氯化银沉淀200克,则该CaCl2中含的杂质可能是( )
| A. | NaCl | B. | BaCl2 | C. | MgCl2 | D. | AlCl3 |
13.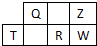 短周期元素Q、R、T、W、Z在元素周期表中的位置如图所示,其中T是该周期离子半径最小的元素,下列说法中不正确的是( )
短周期元素Q、R、T、W、Z在元素周期表中的位置如图所示,其中T是该周期离子半径最小的元素,下列说法中不正确的是( )
 短周期元素Q、R、T、W、Z在元素周期表中的位置如图所示,其中T是该周期离子半径最小的元素,下列说法中不正确的是( )
短周期元素Q、R、T、W、Z在元素周期表中的位置如图所示,其中T是该周期离子半径最小的元素,下列说法中不正确的是( )| A. | Q、Z、W可形成三原子直线型分子 | |
| B. | Z、R两元素气态氢化物的沸点:R>Z | |
| C. | Z、Q两元素的气态氢化物中键能大小:Z>Q | |
| D. | T、W两元素组成的化合物不能通过水溶液中的离子反应制取 |
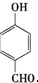 .有人提出,以对甲基苯酚为原料合成PHBA的途径如下:
.有人提出,以对甲基苯酚为原料合成PHBA的途径如下: $→_{①}^{(CH_{3})SO_{4}/OH-}$
$→_{①}^{(CH_{3})SO_{4}/OH-}$ $→_{②}^{Cl_{2}/光照}$C$→_{③}^{NaOH溶液/加热}$D$\stackrel{O_{2}、Cu/加热}{→}$EPHBA
$→_{②}^{Cl_{2}/光照}$C$→_{③}^{NaOH溶液/加热}$D$\stackrel{O_{2}、Cu/加热}{→}$EPHBA
 .
.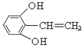 或
或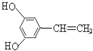 (只写一种).
(只写一种).
