题目内容
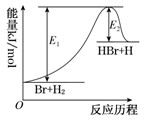
(13分)一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图表示该反应进行过程中的能量变化。
CH3OH(g)+H2O(g),下图表示该反应进行过程中的能量变化。

(1)图中曲线 (填“a”或“b”)表示使用催化剂时的反应进程。使用催化剂对该反应的影响是______(填选项字母)。
(2)CO2(g)+3H2(g) CH3OH(g)+H2O(g)的化学平衡常数的表达式K=_________。升高温度,K值将_______(填“增大”、“减小”或“不变”)。
CH3OH(g)+H2O(g)的化学平衡常数的表达式K=_________。升高温度,K值将_______(填“增大”、“减小”或“不变”)。
(3)用含E1、E2的表达式表示CO2(g)+3H2(g) CH3OH(g)+H2O(g)的ΔH="_____" kJ·mol-1
CH3OH(g)+H2O(g)的ΔH="_____" kJ·mol-1
(4)一定温度下,在体积为2L的容积固定的密闭容器中,充入2molCO2、6molH2,经10min反应达到平衡状态W,生成1molCH3OH。CO2的转化率为________。从反应开始到平衡,用H2的浓度变化表示的平均反应速率v(H2)=____________。该温度下,在体积为1L的容积固定的密闭容器中,从逆反应开始建立化学平衡,且各组分的平衡浓度与平衡状态W完全相同,则起始时充入容器的n(CH3OH)=________,n(H2O)=________。
 CH3OH(g)+H2O(g),下图表示该反应进行过程中的能量变化。
CH3OH(g)+H2O(g),下图表示该反应进行过程中的能量变化。
(1)图中曲线 (填“a”或“b”)表示使用催化剂时的反应进程。使用催化剂对该反应的影响是______(填选项字母)。
| A.提高反应速率 | B.提高CO2的转化率 |
| C.降低反应活化能 | D.改变反应的ΔH |
 CH3OH(g)+H2O(g)的化学平衡常数的表达式K=_________。升高温度,K值将_______(填“增大”、“减小”或“不变”)。
CH3OH(g)+H2O(g)的化学平衡常数的表达式K=_________。升高温度,K值将_______(填“增大”、“减小”或“不变”)。(3)用含E1、E2的表达式表示CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)的ΔH="_____" kJ·mol-1
CH3OH(g)+H2O(g)的ΔH="_____" kJ·mol-1(4)一定温度下,在体积为2L的容积固定的密闭容器中,充入2molCO2、6molH2,经10min反应达到平衡状态W,生成1molCH3OH。CO2的转化率为________。从反应开始到平衡,用H2的浓度变化表示的平均反应速率v(H2)=____________。该温度下,在体积为1L的容积固定的密闭容器中,从逆反应开始建立化学平衡,且各组分的平衡浓度与平衡状态W完全相同,则起始时充入容器的n(CH3OH)=________,n(H2O)=________。
(1)b(1分);AC(1分)(2) (1分);减小(1分)
(1分);减小(1分)
(3)E1—E2(1分)
(4)50%(2分);0.15mol·L-1·min-1 (2分);1mol(2分);1mol(2分)
 (1分);减小(1分)
(1分);减小(1分)(3)E1—E2(1分)
(4)50%(2分);0.15mol·L-1·min-1 (2分);1mol(2分);1mol(2分)
(1)催化剂能降低反应的活化能,所以是b曲线表示有催化剂的。催化剂能够降低反应的活化能,从而同等程度加快正逆反应速率,所以不能影响平衡状态。又因为反应物和生成物的总能量是不变的,所以反应热是不变的,答案选AC。
(2)平衡常数是指在一定条件下的可逆反应中,当反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该反应的平衡常数K= 。应用反应物的能量高,生成物的能量低,所以是放热反应。因此升高温度,平衡向逆反应方向进行,极平衡常数减小。
。应用反应物的能量高,生成物的能量低,所以是放热反应。因此升高温度,平衡向逆反应方向进行,极平衡常数减小。
(3)反应热就是反应物的和生成物总能量的差值,所以根据图像可知,该反应的反应热是ΔH= E1—E2。
(4)平衡时生成1molCH3OH,则根据方程式可知,必然消耗CO2是1mol,所以CO2的转化率是1÷2×10=50%。应用消耗氢气是3mol,所以用氢气表示的反应速率就是 。应用容器容积减半,所以要使平衡等效,则反应物的量也要减半,即CO2和氢气的物质的量分别是1mol和3mol。所以要从逆反应开始,则甲醇和水蒸气的物质的量都是1mol。
。应用容器容积减半,所以要使平衡等效,则反应物的量也要减半,即CO2和氢气的物质的量分别是1mol和3mol。所以要从逆反应开始,则甲醇和水蒸气的物质的量都是1mol。
(2)平衡常数是指在一定条件下的可逆反应中,当反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该反应的平衡常数K=
 。应用反应物的能量高,生成物的能量低,所以是放热反应。因此升高温度,平衡向逆反应方向进行,极平衡常数减小。
。应用反应物的能量高,生成物的能量低,所以是放热反应。因此升高温度,平衡向逆反应方向进行,极平衡常数减小。(3)反应热就是反应物的和生成物总能量的差值,所以根据图像可知,该反应的反应热是ΔH= E1—E2。
(4)平衡时生成1molCH3OH,则根据方程式可知,必然消耗CO2是1mol,所以CO2的转化率是1÷2×10=50%。应用消耗氢气是3mol,所以用氢气表示的反应速率就是
 。应用容器容积减半,所以要使平衡等效,则反应物的量也要减半,即CO2和氢气的物质的量分别是1mol和3mol。所以要从逆反应开始,则甲醇和水蒸气的物质的量都是1mol。
。应用容器容积减半,所以要使平衡等效,则反应物的量也要减半,即CO2和氢气的物质的量分别是1mol和3mol。所以要从逆反应开始,则甲醇和水蒸气的物质的量都是1mol。
练习册系列答案
相关题目


 HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )