题目内容
“氢能”被视为21世纪最具发展潜力的清洁能源。氢气的燃烧效率非常高,只要在汽油中加入4%的氢气,就可使内燃机节油40%。目前,氢能技术在美国、日本、欧盟等国家和地区已进入系统实施阶段。氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) ΔH=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________。
(2)H2S热分解制氢气时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是____________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均为非气体,写出该反应的化学方程式:________________。
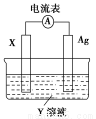
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图中A、B表示的物质依次是________。
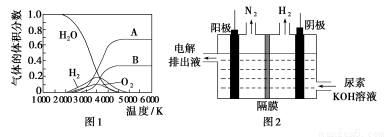
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为________________。
(5)Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为____________。
(1)CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=165.0 kJ·mol-1
(2)为H2S热分解反应提供热量
2H2S+SO2=2H2O+3S↓(或4H2S+2SO2=4H2O+3S2↓)
(3)H、O(或氢原子、氧原子)
(4)CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
(5)2Mg2Cu+3H2 MgCu2+3MgH2
MgCu2+3MgH2
【解析】(1)根据盖斯定律将第一个热化学方程式扩大两倍再减去第二个热化学方程式即得该热化学方程式,ΔH也进行相应的计算得ΔH=206.2 kJ·mol-1×2-247.4 kJ·mol-1=165.0 kJ·mol-1。
(2)硫化氢燃烧放热,为其分解提供能量。硫化氢和二氧化硫反应生成单质硫和水。
(3)1 mol H2O分解首先得到2 mol H和1 mol O,故曲线A为H,曲线B为O。
(4)根据装置图可知阳极产生了N2,阴极产生了H2,再分析元素化合价的升降,可知阴极H+得电子生成氢气,在阳极[CO(NH2)2]失电子生成N2,同时再结合电荷守恒和质量守恒可知还生成CO32-。
(5)根据原子守恒和金属元素氢化物中氢的质量分数为0.077可判断,该金属元素的氢化物为MgH2。

 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为:
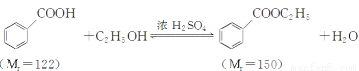
已知:
| 颜色、状态 | 沸点(℃) | 密度(g·cm-3) |
*苯甲酸 | 无色、片状晶体 | 249 | 1.2659 |
苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
*苯甲酸在100 ℃会迅速升华。
实验步骤如下:
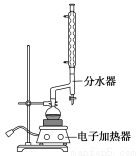
a.在100 mL圆底烧瓶中加入12.20 g苯甲酸、25 mL乙醇(过量)、20 mL 环己烷,以及4 mL浓硫酸,混合均匀并加入沸石,按下图所示装好仪器,控制温度在65~70 ℃加热回流2 h。反应时环己烷—乙醇—水会形成“共沸物”(沸点62.6 ℃)蒸馏出来,再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
b.反应结束,打开旋塞放出分水器中液体后,关闭旋塞。继续加热,至分水器中收集到的液体不再明显增加,停止加热。
c.将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性。
d.用分液漏斗分出有机层,水层用25 mL乙醚萃取分液,然后合并至有机层。加入氯化钙,对粗产物进行蒸馏,低温蒸出乙醚后,继续升温,接收210~213℃的馏分。
e.检验合格,测得产品体积为12.86 mL。
回答下列问题:
(1)①步骤a中使用分水器不断分离除去水的目的是__________________________。
②步骤b中应控制馏分的温度在________。
A.65~70 ℃ B.78~80 ℃ C.85~90 ℃ D.215~220 ℃
③加入乙醇过量的主要原因是____________________________________。
(2)若Na2CO3加入不足,在步骤d蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是_____________________________________________________________________。
(3)关于步骤d中的分液操作叙述正确的是________。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞。将分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃活塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔
(4)该实验的产率为________。