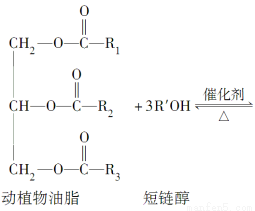
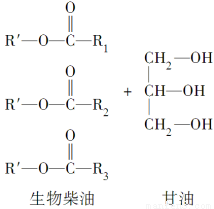
题目内容
如图,将纯铁棒和石墨棒插入1 L饱和NaCl溶液中。下列说法正确的是( )
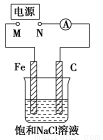
A.将M、N用导线直接相连,在溶液中滴入酚酞溶液,石墨电极周围溶液变红
B.M接电源正极,N接电源负极,当两极产生气体总量为22.4 mL(标准状况)时,则生成0.001 mol NaOH
C.M接电源正极,N接电源负极,将石墨电极换成Cu电极,电解质溶液换成CuSO4溶液,则可实现在铁上镀铜
D.M接电源正极,N接电源负极,若把烧杯中溶液换成1 L CuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀
A
【解析】将M、N用导线直接相连,形成原电池,发生吸氧腐蚀,石墨电极为正极,电极附近产生大量OH-,溶液显碱性,A项正确;阳极不产生气体,阴极产生气体为H2,总量为22.4 mL(标准状况)时,转移电子的物质的量为0.002 mol,则应生成0.002 mol NaOH,NaOH与Fe2+反应生成Fe(OH)2,B项不正确;铁上镀铜时,铁应作阴极,M应接电源负极,C项不正确;M接电源正极,电极反应为Fe-2e-=Fe2+,N接电源负极,电极反应为Cu2++2e-=Cu,反应一段时间后,烧杯中不会产生蓝色沉淀,D项不正确。

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目