题目内容
在密闭容器中进行反应CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是( )
CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是( )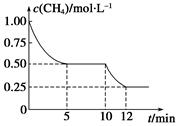
| A.10 min时,改变的外界条件可能是升高温度 |
| B.0~10 min内,v(H2)=0.15 mol·L-1·min-1 |
| C.恒温下,缩小容器体积,一段时间内v逆>v正 |
| D.12 min时,反应达平衡的本质原因是气体总质量不再变化 |
D
解析试题分析:A、升高温度,平衡向右移动,正确;B、3*(1.00-0.50)/10="0.15" mol·L-1·min-1,正确;C、缩小容器体积,气体浓度上升,反应速率提高,压强增大,平衡向左移动,所以一段时间内v逆>v正,正确;D、不管是否达到平衡,气体的总质量都不会变化,错误。
考点:反应平衡与速率。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案决定化学反应速率的根本因素是( )
| A.温度和压强 | B.反应物的浓度 | C.反应物的性质 | D.催化剂 |
可逆反应① 、②
、②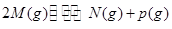 分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
下列判断正确的是:
| A.反应①的正反应是吸热反应 |
| B.在平衡(I)和平衡(II)中的气体摩尔体积相同 |
| C.达平衡(I)时X的体积分数为5/11 |
| D.达平衡(I)时体系的压强与反应开始时体系的压强之比为10:11 |
可逆反应N2+3H2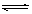 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化表示。下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化表示。下列各关系中能说明反应已达到平衡状态的是
| A.3υ正 (N2)=υ正 (H2) | B.υ正 (N2)=υ逆 (NH3) |
| C.2υ正 (H2)=3υ逆 (NH3) | D.υ正 (N2)=3υ逆 (H2) |
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两实验:(N2O4 2NO2 ΔH>0)
2NO2 ΔH>0)
(a)将两容器置于沸水中加热(b)在活塞上都加2 kg的砝码
(b)在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
| A.(a)甲>乙,(b)甲>乙 | B.(a)甲>乙,(b)甲=乙 |
| C.(a)甲<乙,(b)甲>乙 | D.(a)甲>乙,(b)甲<乙 |
关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛其化学机理为:
① HUr + H2O  Ur- + H3O+ ②Ur- (aq)+Na+(aq)
Ur- + H3O+ ②Ur- (aq)+Na+(aq)  NaUr(s)
NaUr(s)
(尿酸) (尿酸根离子)
下列对反应②叙述中正确的是( )
| A.反应的△H>0 | B.反应的△H<0 |
| C.升高温度平衡向正反应方向移动 | D.改变温度不影响平衡移动 |
温度为T时,向2 L恒容密闭容器中充入1 mol PCl5,发生PCl5(g)  PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是( )
PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是( )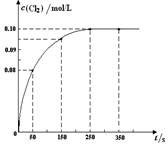
| A.反应在0 ~50 s 的平均速率v(Cl2) =1.6×10-3mol/(L·s) |
| B.该温度下,反应的平衡常数K = 0.025(不考虑单位) |
| C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则该反应的ΔH <0 |
| D.反应达平衡后,再向容器中充入 1 mol PCl5,该温度下再达到平衡时,0.1 mol/L<c(Cl2)<0.2 mol/L |
下列说法正确的是( )
| A.增大反应物的量化学反应速率一定加快 |
| B.升高温度可使放热反应速率减慢,吸热反应速率加快 |
| C.增大压强化学反应速率一定加快 |
| D.使用催化剂能加快反应速率 |