题目内容
温度为T时,向2 L恒容密闭容器中充入1 mol PCl5,发生PCl5(g)  PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是( )
PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是( )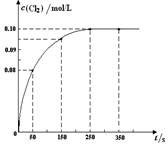
| A.反应在0 ~50 s 的平均速率v(Cl2) =1.6×10-3mol/(L·s) |
| B.该温度下,反应的平衡常数K = 0.025(不考虑单位) |
| C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则该反应的ΔH <0 |
| D.反应达平衡后,再向容器中充入 1 mol PCl5,该温度下再达到平衡时,0.1 mol/L<c(Cl2)<0.2 mol/L |
C
解析试题分析:A、由图可知,0~50s 内Cl2的浓度变化量为0.08mol/L,根据v=△c/△t计算v(Cl2)=1.6×10-3mol/(L?s),正确;B、由图可知,250s时达到平衡,平衡时c(Cl2)=0.1mol/L,利用三段式计算平衡时各组分的浓度,代入平衡常数表达式计算,
PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
开始(mol/L):0.5 0 0
变化(mol/L):0.1 0.1 0.1
平衡(mol/L):0.4 0.1 0.1
故该温度下平衡常数k=0.025,正确;C、由B可知,平衡时c(PCl3)=0.1mol/L,保持其他条件不变,升高温度,平衡时c′(PCl3)=0.11mol/L,浓度增大,平衡向正反应移动,该反应为吸热反应,△H>0,错误; D、反应达平衡后,再向容器中充入 1mol PCl5,平衡向正反应移动,等效为增大压强,增大压强,与原平衡相比PCl5转化率降低,故达平衡时0.1mol/L<c(Cl2)<0.2mol/L,正确。
考点:考查化学平衡图象、化学反应速率和平衡常数计算、化学平衡影响因素等。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: ΔH=a kJ·mol—1。
ΔH=a kJ·mol—1。
经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
A.反应在前20 min的平均速率为v(H2)=0.008mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol·L-1,则a<0
C.保持其他条件不变,再向容器中充入0.40 mol乙苯和0.40molH2,平衡不移动
D.达平衡状态的标志是气体密度不再变化
在密闭容器中进行反应CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是( )
CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是( )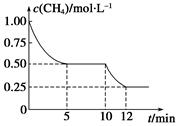
| A.10 min时,改变的外界条件可能是升高温度 |
| B.0~10 min内,v(H2)=0.15 mol·L-1·min-1 |
| C.恒温下,缩小容器体积,一段时间内v逆>v正 |
| D.12 min时,反应达平衡的本质原因是气体总质量不再变化 |
在t℃时,向一密闭容器(固定体积)中放入1mol A和1mol B,发生反应A(s) + B(g)  C(g) + 2D(g)达平衡时C的含量为m%,保持温度不变,若按下列配比的物质放入该容器中,达平衡时C的含量仍为m%的是( )
C(g) + 2D(g)达平衡时C的含量为m%,保持温度不变,若按下列配比的物质放入该容器中,达平衡时C的含量仍为m%的是( )
| A.2molA和1molB | B.2molD,1molA和1molB |
| C.2molC和4molD | D.1molC和1molD |
在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是
| A.反应混合物的浓度 | B.反应体系的压强 |
| C.反应物的转化率 | D.正、逆反应的速率 |
已知2SO2(g) + O2(g) 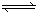 2SO3(g) (正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是
2SO3(g) (正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是
| A.若降低温度,可以减慢反应速率 |
| B.催化剂既能加快化学反应速率,又能提高SO2的转化率 |
| C.氧气足量时,SO2不能完全转化为SO3 |
| D.达到平衡时,SO2和SO3的浓度一定相等 |
可逆反应N2O4 2NO2△H>0在密闭容器中反应,达到平衡状态,要使混合气体颜色加深,可采取的方法是 ①减小压强 ②缩小体积③升高温度④增大N2O4的浓度 ( )
2NO2△H>0在密闭容器中反应,达到平衡状态,要使混合气体颜色加深,可采取的方法是 ①减小压强 ②缩小体积③升高温度④增大N2O4的浓度 ( )
| A.②③④ | B.①②③ | C.①③④ | D.①②③④ |
 2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )
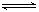 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是