题目内容
下列变化需克服相同类型作用力的是
| A.碘和干冰的升华 | B.硅和C60的熔化 | C.氯化氢和氯化钾的溶解 | D.溴和汞的气化 |
A
解析试题分析:A、碘和干冰均为分子晶体,升华时均克服分子间作用力,正确;B、硅是原子晶体,熔化时克服共价健,C60是分子晶体,熔化时克服分子间作用力,错误;C、氯化氢、氯化钾溶解时分别克服共价键、离子键,错误;D、溴与汞的气化分别克服分子间作用力、金属键,错误。
考点:考查晶体类型、化学键类型的判断,考查学生的分析能力。

 考前必练系列答案
考前必练系列答案把铜粉放入装有浓氨水的试管中,塞紧试管塞,振荡后发现试管塞越来越紧,且溶液逐渐变为浅黄色(近乎无色)溶液,打开试管塞后,溶液迅速变为蓝色溶液。则下列说法不正确的是 ( )
| A.试管塞越来越紧,是因为反应消耗了大量O2 |
| B.打开试管塞前Cu元素的化合价为+1价 |
C.溶液迅速变为蓝色溶液,是因为反应生成了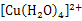 |
| D.上述反应原理可用于测定O2的含量 |
硫的卤化物(S2X2)是广泛用于橡胶工业的硫化剂,S2C12分子结构如图所示。遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2C12+2H2O=SO2↑+3S↓+4HCl。下列说法中错误的是( )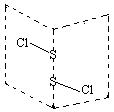
| A.稳定性S2C12>S2Br2 |
| B.反应中,生成1molSO2,转移电子为3mol |
| C.分子中同时含有极性键和非极性键且各原子都满足8电子稳定结构 |
| D.因为S-Cl键能比S-Br键能大,S2C12沸点比S2Br2高 |
氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是 ( )
| A.氯化硼液态时能导电而固态时不导电 | B.氯化硼中心原子采用sp杂化 |
| C.氯化硼分子呈正三角形,属非极性分子 | D.其分子空间结构类似氯化磷 |
下列有关说法中,不正确的是( )
| A.离子晶体的晶格能越大,离子晶体的熔点越高 |
| B.碘单质在水中溶解度很小,但在CCl4中溶解度很大,这是因为CCl4和I2都是非极性分子,而H2O是极性分子 |
| C.成键原子的原子轨道重叠越多,共价键越牢固 |
| D.含有金属阳离子的晶体一定是离子晶体 |
对P4S3分子的结构研究表明,该分子中不存在不饱和键,且各原子最外层均已达到8个电子稳定结构。则一个P4S3分子中含有的共价键个数为
| A.7个 | B.9个 | C.19个 | D.不能确定 |
下列说法正确的是( )
①离子化合物一定含离子键,也可能含极性键或非极性键
②同位素的性质几乎完全相同
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
| A.①③⑤ | B.②④⑤ | C.②③④ | D.①③ |
科学家曾预言一种可用作炸药的物质,分子式为C(N3)4,其爆炸反应方程式为:C(N3)4=C+6N2↑,下列说法一定正确的是
| A.该物质为离子晶体 |
| B.该物质可通过C60吸附N2直接制得 |
| C.18g该物质完全分解产生13.44LN2 |
| D.C(N3)4中碳元素为正价 |
X、Y为两种短周期元素,其原子的最外层电子数分别是1和6,则X、Y两种元素形成的常见化合物或者离子不可能是( )
| A.只含极性键的共价化合物 |
| B.含非极性键的共价化合物 |
| C.阴阳离子个数之比为1∶1的离子化合物 |
| D.可形成双核离子或者四核离子 |