题目内容
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式___________。
(2)AsCl3分子的立体构型为_________,其中As的杂化轨道类型为________。
(3)GaF3的熔点高于1000℃,GaCl2的熔点为77.9℃,其原因是______________。
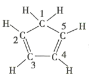
(4)GaAs的熔点为1238℃,密度为ρ g/cm3,其晶胞结构如图所示。该晶体的类型为______________,Ga与As以______________键结合。Ga和As的摩尔质量分别为MGa g/mol和MAs g/mol,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为______________。

【答案】[Ar]3d104s24p3 三角锥形 sp3 GaF3为离子晶体,GaCl3为分子晶体 原子晶体 共价 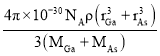 ×100%
×100%
【解析】
(1)As是33 号元素,原子核外有33个电子,根据构造原理书写As原子核外电子排布式为[Ar]3d104s24p3;
(2)AsCl3分子中As原子价层电子对个数=3+![]() =4,且含有一个孤电子对,根据价层电子对互斥理论可知该分子的立体构型为三角锥形,As原子杂化方式为sp3杂化;
=4,且含有一个孤电子对,根据价层电子对互斥理论可知该分子的立体构型为三角锥形,As原子杂化方式为sp3杂化;
(3)离子晶体熔沸点较高、分子晶体熔沸点较低,GaF3的熔点高,说明其为离子晶体,GaCl3的熔点为77.9℃,比较低,则GaCl3为分子晶体,所以前者沸点高于后者;
(4)GaAs的熔点为1238℃,熔点较高,原子之间以共价键结合形成属于原子晶体;密度为ρg/cm3,根据均摊法计算,As:8×![]() +6×
+6×![]() =4;Ga:4×1=4,故其晶胞中原子所占的体积V1=(
=4;Ga:4×1=4,故其晶胞中原子所占的体积V1=(![]() )×10-30 cm3,晶胞的体积V2=
)×10-30 cm3,晶胞的体积V2=![]() cm3,故GaAs晶胞中原子的体积占晶胞体积的百分率为
cm3,故GaAs晶胞中原子的体积占晶胞体积的百分率为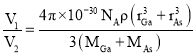 ×100%。
×100%。

【题目】以赤铁矿(主要成分为60.0%Fe2O3,杂质为3.6%FeO,Al2O3,MnO2,CuO等)为原料制备高活性铁单质的主要生产流程如图所示:

已知部分阳离子以氢氧化物形式完全沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Cu(OH)2 |
pH | 3.4 | 5.2 | 9.7 | 6.7 |
请回答下列问题:
(1)含杂质的赤铁矿使用前要将其粉碎,目的是___。操作Ⅰ的名称是___。
(2)将操作Ⅰ后所得的MnO2与KClO3、KOH溶液混合共热,可得到K2MnO4,此反应的化学方程式是____。
(3)将pH控制在3.6的目的是___。已知25℃时,Ksp[Cu(OH)2]=2×10-20,该温度下反应Cu2++2H2O![]() Cu(OH)2+2H+的平衡常数K=___。
Cu(OH)2+2H+的平衡常数K=___。
(4)加入双氧水时反应的离子方程式为___。
(5)利用氨气在500℃以上分解得到的氮原子渗透到铁粉中可制备氮化铁(FexNy),若消耗氨气17.0g,消耗赤铁矿石1kg,写出该反应完整的化学方程式:___。