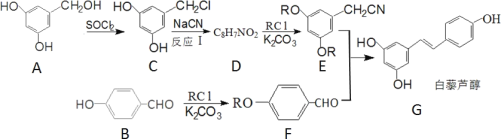
题目内容
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25℃) | Ka= 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7Ka2=5.6×l0-11 |
①0.1moI/LNaCN溶液和0.1mol/LNaHCO3溶液中,c(CN-)___c(HCO3-)(填“>”、“<”或“=”)。
②常温下,物质的量浓度相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其pH由大到小的顺序是___(填编号)。
③将少量CO2通入NaCN溶液,反应的离子方程式是_____。
④室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是_____,溶液中c(CH3COO-)/c(CH3COOH)=____。
(2)某温度下,pH=3的盐酸中[OH-]=10-9mol/L。该温度下, pH=2的H2SO4与pH=11的NaOH混合后pH变为9,则硫酸与氢氧化钠的体积比为____。
(3)室温下,用0.100mol/L盐酸溶液滴定20.00mL0.l00mol/L的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。
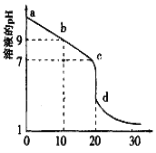
①d点所示的溶液中离子浓度由大到小的顺序依次为______。
②b点所示的溶液中c(NH4+)-c(NH3·H2O)=_____(写出准确数值)。
【答案】< CBA CN-+CO2+H2O=HCN+HCO3- CH3COO-+H2O![]() CH3COOH+OH- l.8×104 9:1 c(C1-)>c(NH4+)>c(H+)>c(OH-) 2(10-5-10-9)
CH3COOH+OH- l.8×104 9:1 c(C1-)>c(NH4+)>c(H+)>c(OH-) 2(10-5-10-9)
【解析】
(1)①根据表格中数据可知,HCN电离出的H+小于H2CO3电离出H+能力,根据盐类水解中越弱越水解,即CN-水解的能力强于HCO3-,因此等浓度的NaCN溶液和NaHCO3溶液中,c(CN-)<c(HCO3-);
②电离平衡常数越小,酸越弱,因此根据电离平衡常数可知,酸性强弱顺序是CH3COOH>H2CO3>HCN>HCO3-。酸越弱,相应的钠盐越容易水解,溶液的pH越大,则等物质的量浓度的A.CH3COONa、B.NaCN、C.Na2CO3的pH由大到小的顺序为C>B>A,故答案为:CBA。
③HCN的电离平衡常数Ka=4.3×10-10,H2CO3的电离平衡常数是Ka1=5.0×10-7、Ka2=5.6×10-11,由此可知电离出H+能力强弱程度为H2CO3>HCN>HCO3-,所以NaCN溶液通入少量CO2的离子方程式是:CN-+CO2+H2O=HCN+HCO3-;
④CH3COONa是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,水解离子反应方程式为CH3COO-+H2O![]() CH3COOH+OH-,
CH3COOH+OH-,![]() =
=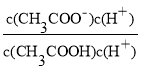 =
=![]() =
=![]() =l.8×104;
=l.8×104;
(2)该温度下,pH=3,即c(H+)=10-3mol/L,而c(OH-)=10-9mol/L,则Kw=10-12,pH=11的NaOH溶液c(OH-)=0.1mol/L,pH=2的H2SO4溶液c(H+)=0.01mol/L,混合后pH变为9,设酸的体积为V1,碱的体积为V2,则混合溶液中c(OH-)=10-3mol/L=![]() =
=![]() ,V1:V2=9:1;
,V1:V2=9:1;
(3)①d点酸碱恰好完全反应生成氯化铵,氯化铵水解导致溶液呈酸性,c(H+)>c(OH-),结合电荷守恒可得c(NH4+)<c(Cl-),但其水解程度较小,d点所示的溶液中离子浓度由大到小的顺序依次为c(Cl-)>c(NH4+)>c(H+)>c(OH-);
②b点溶液中存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(C1-),存在物料守恒:c(NH3·H2O)+c(NH4+)=2c(C1-),所以得到:2c(H+)+ c(NH4+)=2c(OH-)+ c(NH3·H2O),则c(NH4+)-c(NH3·H2O)=2c(H+)-2c(OH-);
(4)溶液中含S的微粒有H2SO![]() ,在pH=1.91时,含HSO3-的物质的量分数为50%,此时可以近似认为c(H2SO3)=c(HSO3-),则Ka1≈c(H+),即pKa1=-lgKa1≈1.91。
,在pH=1.91时,含HSO3-的物质的量分数为50%,此时可以近似认为c(H2SO3)=c(HSO3-),则Ka1≈c(H+),即pKa1=-lgKa1≈1.91。

【题目】现有下列十种物质:①乙醇 ②铜 ③CaO ④CO2 ⑤食醋 ⑥Ba(OH)2⑦红褐色氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩硫酸铁
(1)按物质的分类方法填写表格的空白处:
分类标准 | _______ | 氧化物 | _____ | _____ | 电解质 | 非电解质 |
物质 | ② | _____ | ⑤⑧⑨ | ⑦ | _____ | _____ |
(2)上述十种物质中有两种物质之间可发生离子反应:OH-+ H+=H2O,该反应对应的化学方程式为________________________________。
(3)少量的②加入的溶液中反应⑩的离子方程式为____________________________。