题目内容
根据热化学方程式:S(s)+O2(g) SO2(g) ΔH=a kJ·mol-1(a=-297.2)。分析下列说法,其中不正确的是( )
SO2(g) ΔH=a kJ·mol-1(a=-297.2)。分析下列说法,其中不正确的是( )
 SO2(g) ΔH=a kJ·mol-1(a=-297.2)。分析下列说法,其中不正确的是( )
SO2(g) ΔH=a kJ·mol-1(a=-297.2)。分析下列说法,其中不正确的是( )| A.S(s)在O2(g)中燃烧的反应是放热反应 |
B.S(g)+O2(g) SO2(g) ΔH=b kJ·mol-1,则a>b SO2(g) ΔH=b kJ·mol-1,则a>b |
| C.1 mol SO2(g)所具有的能量低于1 mol S(s)与1 mol O2(g)所具有的能量之和 |
| D.16 g固体硫在空气中充分燃烧,可吸收148.6 kJ的热量 |
D
由题中条件可知:反应的热效应ΔH=a kJ·mol-1="-297.2" kJ·mol-1,可知该反应的正向反应为放热反应,故D错误。

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
 2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:  N2(g)+CO2(g)
N2(g)+CO2(g)  H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:

 2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。 CO(g)+H2(g)。
CO(g)+H2(g)。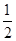 O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1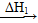 CO2(g)+H2O(g)
CO2(g)+H2O(g)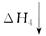

 CO(g)+H2O(g)+
CO(g)+H2O(g)+