题目内容
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性,含VO2+、K+、SO42-等。写出该反应的化学方程式_________________________________。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl-。写出并配平该反应的离子方程式,并标出电子转移的数目和方向______________________。
(3)在20.00 mL的0.1 mol·L-1 VO2+溶液中,加入0.195 g锌粉,恰好完成反应,则还原产物可能是______________________________________________________________。
a.V b.V2+ c.VO2+ d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32->Cl->VO2+__________________________________。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl-。写出并配平该反应的离子方程式,并标出电子转移的数目和方向______________________。
(3)在20.00 mL的0.1 mol·L-1 VO2+溶液中,加入0.195 g锌粉,恰好完成反应,则还原产物可能是______________________________________________________________。
a.V b.V2+ c.VO2+ d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32->Cl->VO2+__________________________________。
(1)V2O5+K2SO3+2H2SO4=2VOSO4+K2SO4+2H2O
(2)ClO3-+6V6e-O2++3H2O=Cl-+6VO2++6H+
(3)b
(4)Cl2+SO32-+H2O=2Cl-+2H++SO42-
(2)ClO3-+6V6e-O2++3H2O=Cl-+6VO2++6H+
(3)b
(4)Cl2+SO32-+H2O=2Cl-+2H++SO42-
(1)K2SO3为还原剂,氧化产物为K2SO4,V2O5为氧化剂,还原产物为VO2+。
(2)KClO3把VO2+氧化成VO2+,本身还原成Cl-,离子方程式为ClO3-+6VO2++3H2O=
Cl-+6VO2++6H+,转移6 mol e-。
(3)根据电子得失守恒得:
 ×2=0.02 mol×0.1 mol·L-1×(5-x)
×2=0.02 mol×0.1 mol·L-1×(5-x)
x=2,b正确。
(4)由已知得:Cl->VO2+,根据Cl2+SO32-+H2O=2Cl-+2H++SO42-
可推出还原性SO32->Cl-。
(2)KClO3把VO2+氧化成VO2+,本身还原成Cl-,离子方程式为ClO3-+6VO2++3H2O=
Cl-+6VO2++6H+,转移6 mol e-。
(3)根据电子得失守恒得:
 ×2=0.02 mol×0.1 mol·L-1×(5-x)
×2=0.02 mol×0.1 mol·L-1×(5-x)x=2,b正确。
(4)由已知得:Cl->VO2+,根据Cl2+SO32-+H2O=2Cl-+2H++SO42-
可推出还原性SO32->Cl-。

练习册系列答案
相关题目

 HSCN+HSCNO],它们阴离子的还原性强弱为:Cl-<Br-<SCN-<I-。试写出以下反应方程式:
HSCN+HSCNO],它们阴离子的还原性强弱为:Cl-<Br-<SCN-<I-。试写出以下反应方程式: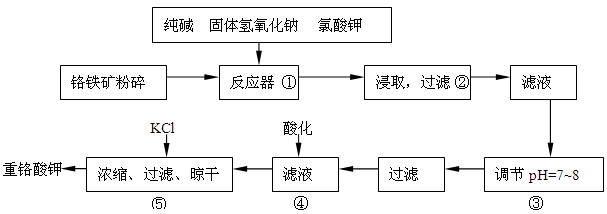
 )既有氧化性又有还原性
)既有氧化性又有还原性 Cu+H2O”反应属于图中的区域 (填序号)。下列反应中属于区域7的有 。
Cu+H2O”反应属于图中的区域 (填序号)。下列反应中属于区域7的有 。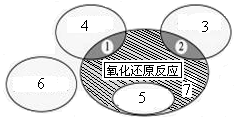
 2H2O
2H2O  Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑ N2+6NH4Cl
N2+6NH4Cl