题目内容
【题目】某化学小组欲进行如下的实验探究金属与浓硫酸反应。试回答下列问题:
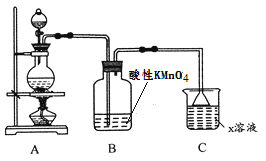
(1)利用上图装置研究铜与浓硫酸反应,反应的化学方程式为_____________________。
(2)C装置的作用___________________。
(3)将上述实验中的铜改为铁,在常温下进行,无明显现象,其原因是_______________。在加热条件下,实验的后阶段可观察到倒立的漏斗边沿有气体冒出,该气体可能为_______。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、Al2O3及不溶于强酸的SiO2)可制备Fe2O3。①用稀盐酸浸取炉渣,过滤;②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
a.除去Al3+的离子方程式是______________________________。
b.步骤②中滤液氧化的目的是_____________________________。
【答案】Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O 吸收多余的SO2,防止污染空气,防倒吸 在常温下,铁在浓硫酸中钝化 氢气或H2 Al3++4OH-=AlO2-+2H2O 将Fe2+氧化为Fe3+
CuSO4+SO2↑+2H2O 吸收多余的SO2,防止污染空气,防倒吸 在常温下,铁在浓硫酸中钝化 氢气或H2 Al3++4OH-=AlO2-+2H2O 将Fe2+氧化为Fe3+
【解析】
应用铝、铁、铜及其化合物的性质,结合浓硫酸的性质分析解答。
(1)铜与浓硫酸反应需要加热,化学方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)SO2是有毒气体,装置C中溶液可吸收多余的SO2,防止污染空气;SO2在水中溶解度较大,装置C中倒置漏斗可防倒吸;
(3)常温下,铁在浓硫酸中会钝化表面形成致密氧化膜。加热条件下,铁与浓硫酸的反应能持续进行,使硫酸浓度减小。反应后期,铁与稀硫酸的反应放出氢气;
(4)a.过量NaOH溶液将Al3+变成AlO2-,离子方程式是Al3++4OH-=AlO2-+2H2O。
b.炉渣中FeO在酸溶时生成了Fe2+,而产品是Fe2O3。故滤液氧化的目的将Fe2+氧化为Fe3+。

【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)滤渣1为_______________,操作A为_________________,向滤液②中加入双氧水的作用是___________________________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因_______________________________。
(4)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?_____________________________________________(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。