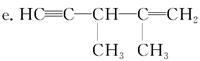
题目内容
从以下6种物质中选取序号填空(仅填序号,可重复选填)。
①二氧化碳;②硫化氢;③氯化铵;④氢氧化钾;⑤乙炔;⑥乙醇
(1)含有非极性键的是 ;
(2)既含有σ键又含有π键的是 ;
(3)含有配位键的是 ;
(4)分子的立体结构呈V形的是 ;
(5)属于非极性分子的是 ;
(6)属于离子化合物的是 。
(1)⑤⑥ (2)①⑤ (3)③ (4)② (5)①⑤ (6)③④
解析试题分析:①二氧化碳是由极性键构成的非极性分子;②硫化氢是由极性键构成的极性分子; ③氯化铵是含有极性键、离子键的离子化合物; ④氢氧化钾是含有极性键、离子键的两种化合物; ⑤乙炔是含有极性键、非极性键的非极性分子;⑥乙醇是含有极性键、非极性键的极性分子。(1)含有非极性键的是⑤⑥;(2)既含有σ键又含有π键的是含有双键或三键的化合物。有①⑤;(3)在氯化铵的阳离子铵根离子中有有个共价键是N原子单方面提供电子与H+共用,是配位键。所以含有配位键的是③;(4)分子的立体结构呈V形的是②H2S;(5)属于非极性分子的是①二氧化碳和⑤乙炔;(6)属于离子化合物的是含有离子键的化合物,有③氯化铵和④氢氧化钾。
考点:考查物质的化学键的类型、分子的空间构型、离子化合物、根据化合物的知识。

科学家曾预言一种可用作炸药的物质,分子式为C(N3)4,其爆炸反应方程式为:C(N3)4=C+6N2↑,下列说法一定正确的是
| A.该物质为离子晶体 |
| B.该物质可通过C60吸附N2直接制得 |
| C.18g该物质完全分解产生13.44LN2 |
| D.C(N3)4中碳元素为正价 |
下列变化中,既有共价键和离子键断裂,又有共价键和离子键形成的是
| A.2Na2O2+2CO2=2Na2CO3+O2 | B.2Na+2H2O=2NaOH+H2↑ |
| C.Cl2+H2O?=?HCl+HclO | D.Na2CO3+BaCl2=BaCO3↓+2NaCl |
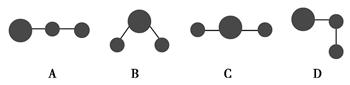
Ⅰ.(1)写出下列电子云的界面图表示的形成的键的类型:
①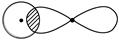
_________________________________________________________________。
②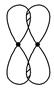
_________________________________________________________________。
③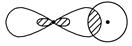
_________________________________________________________________。
④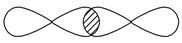
_________________________________________________________________。
(2)下列分子中,没有光学活性的是____________,含有两个手性碳原子的是
____________。
| A.乳酸CH3—CHOH—COOH |
| B.甘油CH2OH—CHOH—CH2OH |
| C.脱氧核糖CH2OH—CHOH—CHOH—CH2—CHO |
| D.核糖CH2OH—CHOH—CHOH—CHOH—CHO |
在乙烷(CH3—CH3)、乙烯(CH2=CH2)、乙炔(CH≡CH)分子中的碳碳键键长大小顺序为__________________________________。BCl3分子中Cl—B—Cl键角为__________,HgCl2分子中的键角为____________。
(3)金属键可以看成是由许多原子共用许多电子形成的,所以有人将金属键视为一种特殊形式的共价键。金属键与共价键的明显区别是①________________、②________________。
水是生命之源,与人类的生活密切相关。在化学实验和科学研究中,水有多种用途。
(1)下列说法中正确的是 (填序号)。
| A.每一个水分子内含有两个氢键 |
| B.水分子间存在范德华力,所以水分子稳定 |
| C.分子间形成的氢键使水的熔点和沸点升高 |
| D.冰熔化时水分子内共价键发生断裂 |
(3)水分子在特定条件下易形成水合氢离子(H3O+)。其中含有的化学键为 。
(4)如果需要增大水的电离程度,除了升高温度外,还可以采用的方法有 (回答一种即可)。若室温时,将某一元酸HA加水配成0.1 mol·L-1的稀溶液,此时HA在水中有0.1%发生电离,则由HA电离出的c(H+)约为水电离出的c(H+)的 倍。
(5)将一定量的Na2SO3固体溶于水,所得溶液中的电荷守恒关系式为 。
(6)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差异进行发电。已知该电池用金属银做负极,正极反应为5MnO2 +2Na++2e-
 Na2Mn5O10,请写出电池总反应式 。
Na2Mn5O10,请写出电池总反应式 。 下列有关晶体的说法中正确的是
| A.氯化钾溶于水时离子键未被破坏 |
| B.原子晶体中共价键越强,熔点越高 |
| C.冰融化时分子中共价键发生断裂 |
| D.范德华力越大,分子越稳定 |