题目内容
【题目】以A(α-蒎烯)为原料可制备香料中间体D和H,合成路线如下:
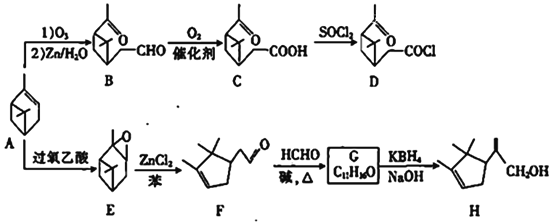
已知:①R1CHO+
![]()
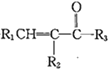 (R1、R2、R3为H或烃基)
(R1、R2、R3为H或烃基)
②一定条件下,R-C≡C-OH可存在。
回答下列问题:
(1)A中的官能团名称是____________,E的分子式为___________
(2)C生成D的反应类型是___________
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。E中有________个手性碳。
(4)G的结构简式为___________
(5)H与足量Br2的CCl4溶液反应的化学方程式为_____________________
(6)W是B的同分异构体,W中没有环状结构,一定条件下,W能水解生成X和Y,X能与NaHCO3反应生成CO2,其核磁共振氢谱只有两组峰,峰面积之比为1:1,Y的核磁共振氢谱有三组峰,蜂面积之比为9:6:1,W的可能结构有_______种.
(7)设计由苯酚制备![]() 的合成路线(无机试剂任选)_________________。
的合成路线(无机试剂任选)_________________。
【答案】碳碳双鍵 C10H16O 取代反应 4 ![]()
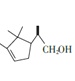 +2Br2
+2Br2![]()
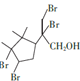 5
5 ![]()
![]()
![]()
![]()
![]()
![]() OHC(CH2)4CHO
OHC(CH2)4CHO![]()
![]()
【解析】
(1)根据A的结构确定所含的官能团,根据E的结构确定其分子式;
(2)C中羧基上的-OH被-Cl替代;
(3)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子,根据E的结构确定手性碳原子的个数;
(4)由已知①可知R1CHO+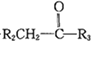
![]()
 ,那么
,那么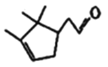 与HCHO反应生成的产物为
与HCHO反应生成的产物为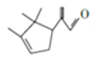 ;
;
(5)H的结构为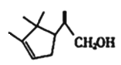 ,存在碳碳双键,可与Br2的CCl4溶液发生加成反应,由于H的结构中存在两个碳碳双键,因此1molH能与2molBr2发生加成反应;
,存在碳碳双键,可与Br2的CCl4溶液发生加成反应,由于H的结构中存在两个碳碳双键,因此1molH能与2molBr2发生加成反应;
(6)由B的结构可知,B的分子式为C10H16O2,W中没有环状结构,一定条件下,W能水解生成X和Y,且X能与NaHCO3反应生成CO2,说明X中存在羧基,其核磁共振氢谱只有两组峰,峰面积之比为1:1,说明X有两种不同环境的氢原子,氢原子的个数比为1:1,X的结构可能是甲酸或丙炔酸;Y为醇,核磁共振氢谱有三组峰,蜂面积之比为9:6:1,说明Y的结构中有三种不同环境的氢原子,氢原子的个数比为9:6:1,据此分析X与Y的结构,并确定W的结构;
(7)根据已知条件可知,目标产物![]() 是由己二醛缩合得到的,己二醛可由环己烯氧化得到,环己烯可由环己醇发生消去反应得到,环己醇可由苯酚与H2发生加成反应得到,由此确定合成路线。
是由己二醛缩合得到的,己二醛可由环己烯氧化得到,环己烯可由环己醇发生消去反应得到,环己醇可由苯酚与H2发生加成反应得到,由此确定合成路线。
(1)根据A的结构可知,结构中存在碳碳双键;根据E的结构可知E的分子式为C10H16
(2)C中羧基上的-OH被-Cl替代,发生取代反应;
(3)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子,有机物E的结构为: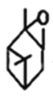 ,其中的手性碳原子为带*的碳原子,即
,其中的手性碳原子为带*的碳原子,即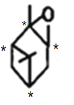 ,共4个;
,共4个;
(4)由已知①可知R1CHO+
![]()
 ,那么
,那么 与HCHO反应生成的产物为
与HCHO反应生成的产物为 ,因此G的结构简式为
,因此G的结构简式为 ;
;
(5)H的结构为 ,存在碳碳双键,可与Br2的CCl4溶液发生加成反应,由于H的结构中存在两个碳碳双键,因此1molH能与2molBr2发生加成反应,反应方程式为:
,存在碳碳双键,可与Br2的CCl4溶液发生加成反应,由于H的结构中存在两个碳碳双键,因此1molH能与2molBr2发生加成反应,反应方程式为: +2Br2
+2Br2![]()
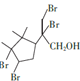 ;
;
(6)由B的结构可知,B的分子式为C10H16O2,W中没有环状结构,一定条件下,W能水解生成X和Y,且X能与NaHCO3反应生成CO2,说明X中存在羧基,其核磁共振氢谱只有两组峰,峰面积之比为1:1,说明X有两种不同环境的氢原子,氢原子的个数比为1:1,X的结构可能是甲酸或丙炔酸;Y为醇,核磁共振氢谱有三组峰,蜂面积之比为9:6:1,说明Y的结构中有三种不同环境的氢原子,氢原子的个数比为9:6:1, Y为(C2H5)3COH或(CH3)3CC(CH3)2OH或(CH3)3CC![]() CC(CH3)2OH或(CH3)3CC(CH3)2C
CC(CH3)2OH或(CH3)3CC(CH3)2C![]() COH或(C2H5)3CCCOH,因此W的结构可能是(C2H5)3COOCC
COH或(C2H5)3CCCOH,因此W的结构可能是(C2H5)3COOCC![]() CH、(CH3)3CC(CH3)2OOCC
CH、(CH3)3CC(CH3)2OOCC![]() CH、(CH3)3CC
CH、(CH3)3CC![]() CC(CH3)2OOCH、(CH3)3CC(CH3)2C
CC(CH3)2OOCH、(CH3)3CC(CH3)2C![]() COOCH、(C2H5)3CC
COOCH、(C2H5)3CC![]() COOCH,共5种;
COOCH,共5种;
(7)根据已知条件可知,目标产物![]() 是由己二醛缩合得到的,己二醛可由环己烯氧化得到,环己烯可由环己醇发生消去反应得到,环己醇可由苯酚与H2发生加成反应得到,因此合成路线为
是由己二醛缩合得到的,己二醛可由环己烯氧化得到,环己烯可由环己醇发生消去反应得到,环己醇可由苯酚与H2发生加成反应得到,因此合成路线为![]()
![]()
![]()
![]()
![]()
![]() OHC(CH2)4CHO
OHC(CH2)4CHO![]()
![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
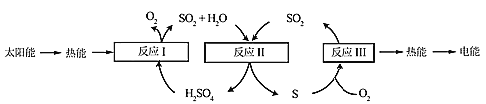
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示:
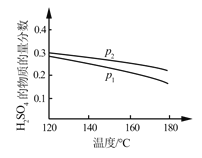
p2_______p 1(填“>”或“<”)。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+_________=_________+_______+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到 2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。
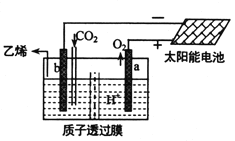
(5)据文献报道,二氧化碳可以在酸性水溶液中用惰性电极电解制得乙烯,其原理如图所示。则b电极上的电极反应式为__________________。