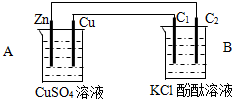
题目内容
(1)今有反应2H2+O2
2H2O,构成燃料电池,则负极通的应是______,电极反应式为:______;正极通的应是______,电极反应式为:______.
(2)如把KOH改为稀H2SO4作电解质,则电极反应式为:负极:______正极:______.
| ||
(2)如把KOH改为稀H2SO4作电解质,则电极反应式为:负极:______正极:______.
①燃料与氧气燃烧的总化学方程式为2H2+O2=2H2O,电解质溶液呈碱性,所以H2在反应中被氧化,O2被还原,H2应在负极发生反应,O2在正极反应,负极的电极方程式为H2-2e-+2OH-=2H2O,正极的电极反应式为:O2+2H2O+4e-=4OH-;
故答案为:H2;H2-2e-+2OH-=2H2O;O2;O2+4e-+2H2O=4OH-;
②如把KOH改为用稀H2SO4作电解质溶液,则负极的电极方程式为:H2-2e-=2H+,正极:O2+4H++4e-=2H2O;
故答案为:H2-2e-=2H+;O2+4H++4e-=2H2O.
故答案为:H2;H2-2e-+2OH-=2H2O;O2;O2+4e-+2H2O=4OH-;
②如把KOH改为用稀H2SO4作电解质溶液,则负极的电极方程式为:H2-2e-=2H+,正极:O2+4H++4e-=2H2O;
故答案为:H2-2e-=2H+;O2+4H++4e-=2H2O.

练习册系列答案
相关题目