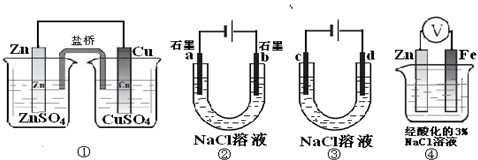
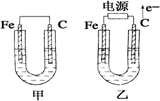
题目内容
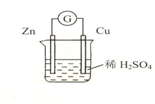
按如图装置进行实验,并回答下列问题:
(1)锌极为______极,电极反应式为______,石墨棒C1为______极,电极反应式为______,石墨棒C2附近发生的实验现象为______.
(2)当C2极析出224mL气体(标准状态)时,锌的质量减少______g.

(1)锌极为______极,电极反应式为______,石墨棒C1为______极,电极反应式为______,石墨棒C2附近发生的实验现象为______.
(2)当C2极析出224mL气体(标准状态)时,锌的质量减少______g.

(1)A能自发的进行氧化还原反应,能将化学能转化为电能,活泼性较强的Zn为负极,电极反应式为Zn-2e-=Zn2+;活泼性较弱的Cu为正极,石墨棒C1与正极相连为阳极,阳极上氯离子失电子生成氯气,其电极反应式为:2Cl--2e-=Cl2;石墨棒C2为阴极,阴极上电解水生成氢气和氢氧根离子,所以阴极附近有气泡,溶液变红,
故答案为:负;Zn-2e-=Zn2+;阳;2Cl--2e-=Cl2;有气泡,溶液变红;
(2)石墨棒C2为阴极,阴极上电解水生成氢气和氢氧根离子,其电极方程式为:4H2O+4e-=2H2↑+4OH-,当C2极析出224mL气体(标准状态)时,生成氢气的物质的量为n(H2)=
=0.01mol,则转移的电子为0.02mol,Zn电极的方程式为:Zn-2e-=Zn2+,根据电子守恒可知,消耗的Zn为0.01mol,则锌的质量减少0.65g,
故答案为:0.65.
故答案为:负;Zn-2e-=Zn2+;阳;2Cl--2e-=Cl2;有气泡,溶液变红;
(2)石墨棒C2为阴极,阴极上电解水生成氢气和氢氧根离子,其电极方程式为:4H2O+4e-=2H2↑+4OH-,当C2极析出224mL气体(标准状态)时,生成氢气的物质的量为n(H2)=
| 0.224L |
| 22.4L/mol |
故答案为:0.65.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目