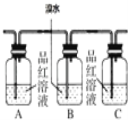
题目内容
【题目】根据实验室制定硫酸铜结晶水含量的实验,填写下列空白:
实验步骤为:①研磨;②准确称取2.0g已经研碎的硫酸铜晶体;③加热;④冷却;⑤称量;⑥重复③至⑤的操作,直至………;⑦根据实验数据计算硫酸铜晶体里结晶水的含量。请回答相关问题:
(1)步骤①需要的实验仪器是____________,步骤④需要使用的仪器是____________,使用此仪器的目的是防止无水硫酸铜在冷却过程中吸收空气中的水蒸气。
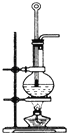
(2)步骤③所用的大部分仪器如下图,在空格中填入仪器的名称:
步骤⑥操作位重复③至⑤的操作,直至_______________________________________
(3)某学生实验后得到以下数据:
加热前质量 | 加热后质量 | |
m1(容器) | m2(容器+晶体) | m3(容器+无水硫酸铜) |
5.400 | 7.900 | 6.800 |
计算:试验测定1mol硫酸铜晶体的结晶水:x=_________________________________,
本次实验的相对误差为______________________。(保留2位小数)
(4)若操作正确,但实验测得的硫酸铜晶体里结晶水的含量偏低。其原因可能是__________(填编号)
A被测样品中含有加热不挥发的杂质 B被测样品中含有加热易挥发的杂质
C实验前被测样品已有部分失水 D加热前所用的坩埚未完全干燥
(5)用重量法测定绿矾(FeSO4xH2O)中结晶水含量,加热失水时必须不断通入氮气,装置如图,

说明反应必须在氮气环境中的原因:
_________________________________________________________________________。
【答案】研体 干燥器 连续两次称量的质量差不超过0.1g为止 6.98 0.40 AC 空气中含有氧气和水蒸气,会是Fe2+发生水解和氧化,所以要在氮气环境中进行
【解析】
(1)首先根据实验步骤中的各步操作,确定所需的实验仪器;
(2)加热固体至恒重;
(3)根据结晶水合物中,结晶水的质量=m(容器十晶体)-m(容器十无水硫酸铜),据化学方程式可以计算结晶水x的值,在测定中若被测样品中含有加热挥发的杂质或实验前容器中有水,都会造成测量结果偏高、偏低;
(4)根据操作过程中引起的固体质量的误差或杂质性质等进行分析判断;
(5)根据+2价铁易被氧化进行分析解答。
(1)步骤①研磨需要的实验仪器是研体,步骤④冷却加热后的固体必须在干燥器中进行,故需要使用的仪器是干燥器,使用此仪器的目的是防止无水硫酸铜在冷却过程中吸收空气中的水蒸气;
(2) 步骤⑥操作位重复③至⑤的操作,直至连续两次称量的质量差不超过0.1g为止;
(3) 硫酸铜晶体的质量为7.900g-5.400g=2.500g,水的质量为7.900g-6.800g=1.100g;
CuSO4·xH2O![]() CuSO4 +xH2O
CuSO4 +xH2O
160+18x 160 18x
2.500g 1.100g
![]() ,解得x=6.98,
,解得x=6.98,
硫酸铜晶体的化学式为CuSO4·5H2O,本次实验的相对误差为![]() ;
;
(4)A、被测样品中含有加热不挥发的杂质,则剩余固体的质量增加,则水的含量偏低,选项A符合;
B、被测样品含有易挥发的杂质,则挥发出去都认为是水,则水的质量变多,则结晶水的含量增加,选项B不符合;
C、实验前被测样品中已经部分失水,则测的水的质量减小,结晶水的含量偏低,选项C符合;
D、坩埚未干燥,则加热时也有水减小,则结晶水的质量增加,含量增加,选项D不符合。
答案选AC;
(5) 空气中含有氧气和水蒸气,会是Fe2+发生水解和氧化,所以要在氮气环境中进行。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】实验室制乙烯时,常因温度过高而发生副反应,使部分乙醇跟浓硫酸反应生成二氧化硫、二氧化碳、水蒸气和炭黑。
(1)写出实验室制取乙烯的化学方程式______________________________
编号 | ① | ② | ③ | ④ |
装置 |
|
|
|
|
(2)请用表中编号为①、②、③、④的装置设计一个实验,以验证上述反应混合气体中含CO2、SO2和水蒸气.用装置的编号表示装置的连接顺序(按产物气流从左到右顺序): ___________________________.
(3)实验时装置①中A瓶的现象是________,B瓶溶液的作用是____________。B中的溴水能否用酸性KMnO4溶液代替,为什么?____________________。
(4)装置③中加的固体药品是________,以验证混合气体中有_____________。装置②中盛的溶液是______________,以验证混合气体中的_________________。
【题目】甲烷是一种重要的基础化工原料,不仅可制备多种重要有机产品,还可用于环境保护。请回答下列问题:
(1)用甲烷催化还原氮的氧化物可消除氮氧化物的污染。已知:

反应过程(2)是__反应(填“放热”或“吸热”),甲烷还原NO2生成H2O(g)、N2和CO2时的热化学方程式是__。
(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应:CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应)。在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应)。在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
实验 序号 | 温度℃ | 初始n(CCl4)( mol) | 初始n(H2)( mol) | 平衡时n(CHCl3)( mol) |
1 | 110 | 0.8 | 1.2 | |
2 | 110 | 2 | 2 | 1 |
3 | 100 | 1 | 1 | 0.6 |
①此反应在110℃时平衡常数为___。
②实验l中,CCl4的转化率为__。
③判断该反应的正反应是__(填“放热”或“吸热”),理由是__。
④为提高实验3中CCl4的转化率,可采取的措施是__。
a.使用高效催化剂
b.向容器中再投入1molCCl4和1molH2
c.温度升高到200℃
d.向容器中再投入1molHCl
e.向容器中再投入1molH2
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)其中V1=_____、T1=_____;通过实验_____(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=______。
(2)若t1<8,则由此实验可以得出的结论是_____;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=_______。
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是_______。