��Ŀ����
����Ŀ��һ���¶��½��з�Ӧ��COCl2(g)![]() Cl2(g)��CO(g)����2.0 L�����ܱ������г���1.0 mol COCl2(g)����Ӧ�����в�õ��й����ݼ��±���
Cl2(g)��CO(g)����2.0 L�����ܱ������г���1.0 mol COCl2(g)����Ӧ�����в�õ��й����ݼ��±���
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
����˵������ȷ����
A.0��4s�����ڵ�ѹǿ������
B.����Cl2��ƽ����Ӧ���ʣ�0��2s��2��4s��
C.8sʱ���������ٳ���һ�����ĺ�������Ӧ�����ֻ�ӿ�
D.�������£�COCl2�����ת����Ϊ40%
���𰸡�C
��������
A��COCl2(g)![]() Cl2(g)��CO(g)������Ӧ�������������ķ�Ӧ������0��4s��������������ʵ�������������������ѹǿ������A��ȷ��
Cl2(g)��CO(g)������Ӧ�������������ķ�Ӧ������0��4s��������������ʵ�������������������ѹǿ������A��ȷ��
B���÷�Ӧ�Ǵ�����Ӧ����ʼ�ģ���Ӧ���Ũ��ԽС����ѧ��Ӧ���������������ŷ�Ӧ�Ľ��У���Ӧ���Ũ����С�����Է�Ӧ��������Cl2��ƽ����Ӧ���ʣ�0��2s��2��4s�죬B��ȷ��
C��8sʱ���������ٳ���һ�����ĺ��������ڲ��ܸı䷴Ӧ��ϵ���κ�һ�����ʵ�Ũ�ȣ����Է�Ӧ���ʲ��䣬C����
D�����ݱ������ݿ�֪�ڷ�Ӧ�ﵽƽ��ʱ������Cl20.40mol�����ݷ�Ӧ����ʽ�����ʵĹ�ϵ��֪��Ӧ����COCl2�����ʵ���Ҳ��0.4mol����ʼ������1mol COCl2,���Ը������£�COCl2�����ת����Ϊ(0.4mol ��1mol)��100%=40%��D��ȷ��
��ѡC��

����Ŀ���ױ�(![]() )��һ����Ҫ�Ļ���ԭ�ϣ���������������ȩ(
)��һ����Ҫ�Ļ���ԭ�ϣ���������������ȩ(![]() )��������(
)��������(![]() )�Ȳ�Ʒ���±��г����й����ʵIJ����������ʣ���ش�
)�Ȳ�Ʒ���±��г����й����ʵIJ����������ʣ���ش�
���� | ��״ | �۵㣨�棩 | �е㣨�棩 | ����ܶ� ����ˮ=1g/cm3�� | �ܽ��� | |
ˮ | �Ҵ� | |||||
�ױ� | ��ɫҺ����ȼ�ӷ� | -95 | 110.6 | 0.8660 | ���� | ���� |
����ȩ | ��ɫҺ�� | -26 | 179 | 1.0440 | �� | ���� |
������ | ��ɫƬ״����״���� | 122.1 | 249 | 1.2659 | �� | ���� |
ע���ױ�������ȩ�������������ܡ�
ʵ���ҿ�����ͼװ��ģ���Ʊ�����ȩ��ʵ��ʱ��������ƿ�м���0.5g��̬�����Դ������ټ���15mL������(��Ϊ�ܼ�)��2mL�ױ�������������70�棬ͬʱ��������12mL�������⣬�ڴ��¶��½��跴Ӧ3Сʱ��

��1��װ��a��������__________________����Ҫ������____________________��
��2������ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ_______________________________________���˷�Ӧ��ԭ�������������Ͽɴ�___________����ԭ��������=(���������������/ȫ����Ӧ���������)��100%��
��3�����ⶨ����Ӧ�¶�����ʱ���ױ���ת�����������¶ȹ���ʱ������ȩ�IJ���ȴ�������٣����ܵ�ԭ����________________________________________________��
��4����Ӧ��Ϻ�Ӧ���Һ������Ȼ��ȴ������ʱ����Ӧ���� ________��________(���������)�Ȳ��������ܵñ���ȩ�ֲ�Ʒ��
��5��ʵ���м���������������ҷ�Ӧʱ��ϳ�����ʹ����ȩ��Ʒ�в����϶�ı����ᡣ����ӻ��б�����ı���ȩ�з���������ᣬ��ȷ�IJ���������_______(������˳������ĸ)��
a.�Ի��Һ���з�Һ b.���ˡ�ϴ�ӡ�����
c.ˮ���м����������pH��2 d.��������̼��������Һ�����
����Ŀ�������¶��£���10mL0.40mol/LH2O2 ��Һ�м�������FeCl3��Һ(����������������Һ����ı仯),��ͬʱ�̲������O2�����(������Ϊ��״����)�����ʾ��
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.5 | 22.4 |
������ʾ,��Ӧ���������У���2Fe3++H2O2��2Fe2++2H++O2����H2O2+2Fe2++2H+��2H2O+2Fe3+����Ӧ�����������仯��ͼ��ʾ������˵����ȷ����
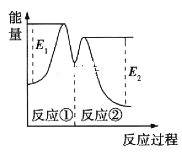
A. Fe2+�������������������ķֽ�����
B. ��Ӧ�١��ھ��Ƿ��ȷ�Ӧ
C. ��Ӧ2H2O2(aq)��2H2O(l)+O2(g)�����ȷ�Ӧ
D. 0��6min�ڵ�ƽ����Ӧ����v(H2O2)��3.33��10-2mol/(L��min)