题目内容
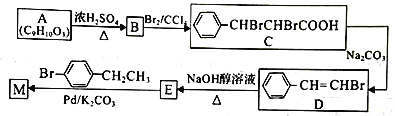
【题目】中科院董绍俊课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池,如图所示,该电池可将可乐(pH=2.5)中的葡萄糖作为燃料产生能量。下列说法正确的是( )
A.a极为正极
B.随着反应的进行,负极区的pH不断增大
C.消耗0.1mol葡萄糖,电路中转移0.2mol电子
D.b极的电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
【答案】C
【解析】
根据原电池装置图分析,葡萄糖(![]() )发生氧化反应生成葡糖糖内酯(
)发生氧化反应生成葡糖糖内酯(![]() ),则a极为负极,电极反应式为
),则a极为负极,电极反应式为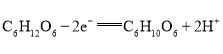 ,b极为正极,MnO2得到电子,发生还原反应,酸性条件下电极反应式为
,b极为正极,MnO2得到电子,发生还原反应,酸性条件下电极反应式为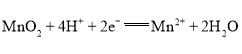 ,据此结合选项分析可解答问题。
,据此结合选项分析可解答问题。
A.葡萄糖(![]() )发生氧化反应生成葡糖糖内酯(
)发生氧化反应生成葡糖糖内酯(![]() ),则a极为负极,A选项错误;
),则a极为负极,A选项错误;
B.根据负极电极反应,随着反应的进行,负极区的氢离子浓度逐渐增大,其溶液的![]() 不断减小,B选项错误;
不断减小,B选项错误;
C.由上述分析可知,负极的电极反应式为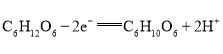 ,消耗
,消耗![]() 葡萄糖,转移
葡萄糖,转移![]() 电子,C项正确;
电子,C项正确;
D.因电解质溶液呈酸性,则b极的电极反应式为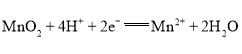 ,D选项错误;
,D选项错误;
答案选C。

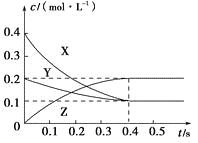
【题目】—定温度下,向10mL0.40mol/LH2O2 溶液中加入少量FeCl3溶液(忽略整个过程中溶液体积的变化),不同时刻测得生成O2的体积(已折算为标准状况下)如表所示:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.5 | 22.4 |
资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++2H++O2;②H2O2+2Fe2++2H+=2H2O+2Fe3+。反应过程中能量变化如图所示。下列说法正确的是
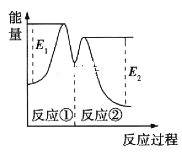
A. Fe2+的作用是增大过氧化氢的分解速率
B. 反应①、②均是放热反应
C. 反应2H2O2(aq)=2H2O(l)+O2(g)是吸热反应
D. 0~6min内的平均反应速率v(H2O2)=3.33×10-2mol/(L·min)