题目内容
一定体积的二氧化碳被体积为V mL的氢氧化钠溶液完全吸收后,经检验发现溶液中的氢氧化钠已经完全反应。将上述反应后的液体分为两等份。
(1)甲同学向其中的一份加入足量的澄清石灰水,得到沉淀的质量为M g。据此,能否确定最初通入的CO2在标准状况下的体积?如果能,请列出计算式;如果不能,请在下面的横线上填写“不能”。
答:_________________________________________________________________________。
能否据此确定氢氧化钠溶液的浓度?如果能,请列出计算式;如果不能,请在下面的横线上填写“不能”。
答:___________________________________________________________________________。
(2)乙同学向第二份溶液中滴加足量的CaCl2溶液,最终得到干燥沉淀N g。据此判断M与N的相对大小关系是:__________________________________________________。
(1)甲同学向其中的一份加入足量的澄清石灰水,得到沉淀的质量为M g。据此,能否确定最初通入的CO2在标准状况下的体积?如果能,请列出计算式;如果不能,请在下面的横线上填写“不能”。
答:_________________________________________________________________________。
能否据此确定氢氧化钠溶液的浓度?如果能,请列出计算式;如果不能,请在下面的横线上填写“不能”。
答:___________________________________________________________________________。
(2)乙同学向第二份溶液中滴加足量的CaCl2溶液,最终得到干燥沉淀N g。据此判断M与N的相对大小关系是:__________________________________________________。
(1)能 2×22.4 L·mol-1×M g/100 g·mol-1(即0.448M L) 不能
(2)M≥N
(2)M≥N
(1)由题意知,CO2与NaOH恰好完全反应,可能反应为:CO2+2NaOH====Na2CO3+H2O CO2+NaOH====NaHCO3
向反应后的第一份溶液中加入足量澄清石灰水时,可能反应为:Na2CO3+Ca(OH)2====CaCO3↓+2NaOH,NaHCO3+Ca(OH)2====CaCO3↓+H2O+NaOH,根据上述四个反应方程式可得关系式:CO2—CaCO3↓。
第一份:n(CO2)=n(CaCO3)=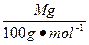 ,最初通入的CO2体积为:V(CO2)="2×22.4" L·mol-1×M g/100 g·mol-1="0.448M" L。
,最初通入的CO2体积为:V(CO2)="2×22.4" L·mol-1×M g/100 g·mol-1="0.448M" L。
由于不知道NaOH的物质的量,故不能确定NaOH溶液的浓度。
(2)向第二份溶液中滴加足量的CaCl2溶液时,由于溶液中可能只有Na2CO3,也可能是Na2CO3与NaHCO3的混合溶液,故只发生反应CaCl2+Na2CO3====CaCO3↓+2NaCl,所以M≥N。
向反应后的第一份溶液中加入足量澄清石灰水时,可能反应为:Na2CO3+Ca(OH)2====CaCO3↓+2NaOH,NaHCO3+Ca(OH)2====CaCO3↓+H2O+NaOH,根据上述四个反应方程式可得关系式:CO2—CaCO3↓。
第一份:n(CO2)=n(CaCO3)=
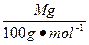 ,最初通入的CO2体积为:V(CO2)="2×22.4" L·mol-1×M g/100 g·mol-1="0.448M" L。
,最初通入的CO2体积为:V(CO2)="2×22.4" L·mol-1×M g/100 g·mol-1="0.448M" L。由于不知道NaOH的物质的量,故不能确定NaOH溶液的浓度。
(2)向第二份溶液中滴加足量的CaCl2溶液时,由于溶液中可能只有Na2CO3,也可能是Na2CO3与NaHCO3的混合溶液,故只发生反应CaCl2+Na2CO3====CaCO3↓+2NaCl,所以M≥N。

练习册系列答案
相关题目
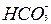 +H+
+H+ CO2↑+H2O
CO2↑+H2O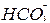
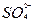
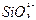 +H2O+CO2
+H2O+CO2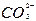 +H2SiO3↓
+H2SiO3↓