题目内容
【题目】已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸 | CH3COOH | H2CO3 |
电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则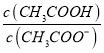 =18
=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
【答案】C
【解析】A.弱酸根离子水解是分步进行,向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+H2O![]() HCO3-+OH-,故A错误;B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,醋酸的电离平衡表示式为K=c(CH3COO-)c(H+)/c(CH3COOH),1.8×10-5/10-6= c(CH3COO-)/c(CH3COOH),
HCO3-+OH-,故A错误;B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,醋酸的电离平衡表示式为K=c(CH3COO-)c(H+)/c(CH3COOH),1.8×10-5/10-6= c(CH3COO-)/c(CH3COOH), 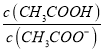 =1/18,B错误;C. NaHCO3溶液中的物料守恒为:c(Na+)= c(H2CO3)+c(HCO3-) +c(CO32-),电荷守恒为:c(H+)+c(Na+)=c(OH-)+c(HCO3-) +2c(CO32-),两式联列得:c(OH-) +c(CO32-)=c(H2CO3)+c(H+),故C正确;D.已知Ksp(CaCO3)=2.8×10-9= c(CO32-) c(Ca2+),2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合,c(CO32-)= 2×10-4 mol/L×/2V=1×10-4 mol/L,代入公式,得c(Ca2+)=2.8×10-5 mol/L,则原CaCl2溶液中c(Ca2+)≥2.8×10-5 mol/L×2==5.6×10-5 mol/L,故D错误。
=1/18,B错误;C. NaHCO3溶液中的物料守恒为:c(Na+)= c(H2CO3)+c(HCO3-) +c(CO32-),电荷守恒为:c(H+)+c(Na+)=c(OH-)+c(HCO3-) +2c(CO32-),两式联列得:c(OH-) +c(CO32-)=c(H2CO3)+c(H+),故C正确;D.已知Ksp(CaCO3)=2.8×10-9= c(CO32-) c(Ca2+),2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合,c(CO32-)= 2×10-4 mol/L×/2V=1×10-4 mol/L,代入公式,得c(Ca2+)=2.8×10-5 mol/L,则原CaCl2溶液中c(Ca2+)≥2.8×10-5 mol/L×2==5.6×10-5 mol/L,故D错误。

【题目】现有一瓶A和B的混合物,已知甲和乙的某些性质如表所示:( )
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水中的溶解性 |
A | -75 | 66 | 0.93 | 可溶 |
B | -66 | 110 | 0.90 | 可溶 |
据此,将甲和乙互相分离的方法是( )
A.蒸馏法B.升华法C.萃取法D.过滤法