题目内容
【题目】有一种被称为“软电池”的纸质电池,其总反应为:Zn+2MnO2+H2O=ZnO+2MnOOH。下列说法正确的是( )

A.该电池中Zn作正极
B.Zn电极上发生还原反应
C.该电池工作时电流由Zn经导线流向MnO2
D.当6.5gZn完全溶解时,流经电路的电子个数约为1.204×l023
【答案】D
【解析】
A.由电池的总反应:Zn+2MnO2+H2O=ZnO+2MnOOH,可知Zn的化合价由0价变为+2价,Zn失电子作负极,故A错误;
B.Zn是负极,失电子,发生氧化反应,故B错误;
C.该电池工作时电流是由正极流向负极,电流从MnO2经导线流向Zn,故C错误;
D.根据电极反应,负极:Zn-2e-=Zn2+,1molZn溶解,转移2mol电子,则6.5gZn为0.1mol,转移的电子数约为0.1×2×6.02×1023=1.204×1023,故D正确;
答案为D。

【题目】化工原料异丁烯(C4H8)可由异丁烷(C4H10)直接催化脱氢制备:C4H10(g) ![]() C4H8(g) + H2(g)ΔH=+139 kJ/mol
C4H8(g) + H2(g)ΔH=+139 kJ/mol
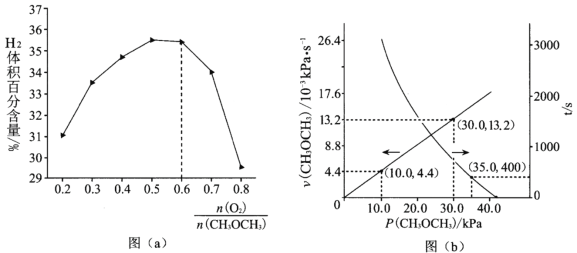
(1)该反应的化学平衡常数的表达式为_________________。
(2)一定条件下,以异丁烷为原料生产异丁烯。温度、压强改变对异丁烷平衡转化率的
影响如下图所示。
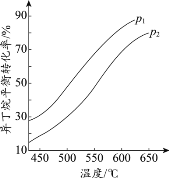
①判断p1、p2的大小关系:p1_________________(填“>”或“<”)p2,理由是_________________。
②若异丁烷的平衡转化率为40%,则平衡混合气中异丁烯的物质的量分数最多为______%(保留小数点后1位)。
(3)目前,异丁烷催化脱氢制备异丁烯的研究热点是催化活性组分以及载体的选择。下表是以V-Fe-K-O为催化活性物质,反应时间相同时,测得的不同温度、不同载体条件下的数据。
温度/℃ | 570 | 580 | 590 | 600 | 610 | |
以γ-Al2O3为载体 | 异丁烷转化率/% | 36.41 | 36.49 | 38.42 | 39.23 | 42.48 |
异丁烯收率/% | 26.17 | 27.11 | 27.51 | 26.56 | 26.22 | |
以TiO2为载体 | 异丁烷转化率/% | 30.23 | 30.87 | 32.23 | 33.63 | 33.92 |
异丁烯收率/% | 25.88 | 27.39 | 28.23 | 28.81 | 29.30 | |
说明:收率=(生产目标产物的原料量/原料的进料量)×100%
①由上表数据,可以得到的结论是____________(填字母序号)。
a.载体会影响催化剂的活性
b. 载体会影响催化剂的选择性
c.载体会影响化学平衡常数
②分析以γ-Al2O3为载体时异丁烯收率随温度变化的可能原因:___________。
【题目】硫酸镍是电镀工业必不可少的化工原料。从不锈钢废渣(主要含Fe 42.35%、Cr 9.67%、Ni 5.1%、C 4.7%、Si 3.39%等)中制取硫酸镍晶体的工艺流程如下:
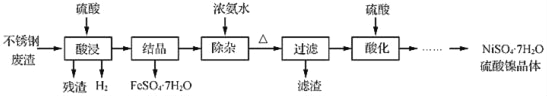
已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
②Na2CrO4溶液中加酸调节pH为3.5时,CrO42﹣转化为Cr2O72﹣。
③相关物质在不同温度时溶解度如下表:
温度溶解度/g物质 | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 90℃ |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
(1)“酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,生成NiSO4的化学方程式为_____。“酸浸”时需控制温度为90℃左右,可以采用的加热方式是_____。
(2)“过滤”前,适当加热的目的是_____。
(3)对“过滤”所得的滤渣进行洗涤,检验滤渣已洗涤干净的方法是_____。
(4)“过滤”时产生的滤渣可用于制备Na2Cr2O7晶体。
①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为_____。
②请补充完整上述煅烧后混合物制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,_____,得Na2Cr2O7晶体(必须使用的试剂有:硫酸,蒸馏水)。