题目内容
【题目】A、D、E、W是中学常见的四种元素,原子序数依次增大,A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)W在元素周期表中的位置是___。A与E组成的化合物是常用的溶剂,写出其电子式___。
(2)下列事实能用元素周期表相应规律解释的是(填字母序号)___。
a.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
b.E的气态氢化物的稳定性小于HF
c.A的单质能与二氧化硅高温下制得粗品硅单质
(3)WE3的溶液可用于刻蚀铜制的印刷电路板,反应的离子方程式为____。
(4)①工业上用电解法制备D的单质,反应的化学方程式为___。
②家用“管道通”的有效成分是烧碱和D的单质,使用时需加入一定量的水,此时发生反应的化学方程式为____。
(5)W的单质可用于处理酸性废水中的NO3-,使其转换为NH4+,同时生成有磁性的W的氧化物X,再进行后续处理,上述反应的离子方程式为__。上述W的氧化物X能与D的单质反应,写出该反应的化学方程式为__。
【答案】第四周期,第VⅢ族 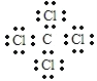 ab 2Fe3++Cu=2Fe2++Cu2+ 2Al2O3(熔融)
ab 2Fe3++Cu=2Fe2++Cu2+ 2Al2O3(熔融)![]() 4A1+3O2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 3Fe+NO3-+2H++H2O=Fe3O4+NH4+ 8Al+3Fe3O4
4A1+3O2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 3Fe+NO3-+2H++H2O=Fe3O4+NH4+ 8Al+3Fe3O4![]() 4Al2O3+9Fe
4Al2O3+9Fe
【解析】
A、D、E、W是中学常见的四种元素,原子序数依次增大,A的原子最外层电子数是次外层的2倍,A为C元素;D的氧化物属于两性氧化物,D为Al元素;D、E位于同周期,A、D、E的原子最外层电子数之和为14,则E的最外层电子数=14-4-3=7,E为Cl元素;W是人体必需的微量元素,缺乏W会导致贫血症状,W为Fe元素,据此分析解答。
根据上述分析,A为C元素,D为Al元素,E为Cl元素,W为Fe元素。
(1)W为Fe元素,在元素周期表中位于第四周期,第VⅢ族;A为C元素,E为Cl元素,组成的化合物是常用的溶剂为四氯化碳,电子式为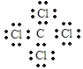 ,故答案为:第四周期,第VⅢ族;
,故答案为:第四周期,第VⅢ族; ;
;
(2)a.同周期元素,从左到右,金属性依次减弱,铝在镁的右边,所以金属性弱于镁,所以氢氧化铝的碱性弱于Mg(OH)2,故a选;b.同主族元素,从上到下,非金属性依次减弱,所以F的非金属性强于Cl,则氢化物稳定性HCl小于HF,故b选;c.高温下,碳能与二氧化硅高温下制得粗品硅单质,是因为生成的CO是气体,沸点远低于二氧化硅,不能用元素周期律解释,故c不选;故答案为:ab;
(3)FeCl3的溶液可用于刻蚀铜制的印刷电路板,是因为铁离子能够氧化铜生成铜离子,反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(4)①工业上用电解氧化铝的方法制备铝,方程式:2Al2O3(熔融)![]() 4Al+3O2↑;故答案为:2Al2O3(熔融)
4Al+3O2↑;故答案为:2Al2O3(熔融)![]() 4Al+3O2↑;
4Al+3O2↑;
②铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,生成的氢气可以有效的疏通管道,反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(5)酸性环境下硝酸根离子具有强的氧化性,能够氧化铁生成四氧化三铁,反应的离子方程式:3Fe+NO3-+2H++H2O=Fe3O4+NH4+;铝与四氧化三铁反应生成氧化铝和铁,方程式:8Al+3Fe3O4![]() 4Al2O3+9Fe,故答案为:3Fe+NO3-+2H++H2O=Fe3O4+NH4+;8Al+3Fe3O4
4Al2O3+9Fe,故答案为:3Fe+NO3-+2H++H2O=Fe3O4+NH4+;8Al+3Fe3O4![]() 4Al2O3+9Fe。
4Al2O3+9Fe。

 阅读快车系列答案
阅读快车系列答案