题目内容
下列各微粒的电子排布式或轨道表示式不符合能量最低原理的是( )
| A、O2-ls22s22p6 |
| B、S2-ls22s22p6 3s23p44s2 |
C、F  |
D、Na+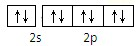 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:能量最低原理:原子核外电子先占有能量较低的轨道,然后依次进入能量较高的轨道,电子填充顺序为1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d、6p、7s、5f、6d、7p,结合泡利原理与洪特规则判断.
解答:
解:A.O2-离子核外电子数为8,由能量最低原理,可知核外电子排布为1s22s22p6,故A不选;
B.选项中未填满3p能级,而填充较高的4s能级,违背能量最低原理,S2-离子核外电子数为18,可知核外电子排布为1s22s22p6 3s23p6,故B错误;
C.F原子最外电子层为第2电子层,有7个电子,外围电子排布为2s22p5,由泡利原理与洪特规则可知,外围电子轨道排布式为 ,故C正确;
,故C正确;
D.Na+离子最外电子层为第2电子层,有8个电子,外围电子排布为2s22p6,由泡利原理与洪特规则可知,外围电子轨道排布式为 ,故D正确,
,故D正确,
故选B.
B.选项中未填满3p能级,而填充较高的4s能级,违背能量最低原理,S2-离子核外电子数为18,可知核外电子排布为1s22s22p6 3s23p6,故B错误;
C.F原子最外电子层为第2电子层,有7个电子,外围电子排布为2s22p5,由泡利原理与洪特规则可知,外围电子轨道排布式为
 ,故C正确;
,故C正确;D.Na+离子最外电子层为第2电子层,有8个电子,外围电子排布为2s22p6,由泡利原理与洪特规则可知,外围电子轨道排布式为
 ,故D正确,
,故D正确,故选B.
点评:本题考查核外电子排布,难度不大,侧重对基础知识的巩固,注意对核外电子排布规律的理解掌握.

练习册系列答案
相关题目
镁、铝、铁、铜四种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有( )
| A、Cu2+ |
| B、AlO2- |
| C、Al3+ |
| D、Mg2+ |
下列说法中正确的一组( )
| A、H2和D2互为同位素 | ||||||
| B、CH3-CH2-OH与CH3-O-CH3互为同分异构体 | ||||||
| C、正丁烷和异丁烷是同素异形体 | ||||||
D、
|
当有机物分子中的一个碳原子所连四个原子或原子团均不相同时,此碳原子就是“手性碳原子”,具有手性碳原子的物质往往具有旋光性,存在对映异构体,下列化合物中存在对映异构体的是( )
| A、C2H5CH═CHCH(CH3)-CH═CHC2H5 |
B、 |
| C、HCOOH |
| D、C6H5CH(CH3)CHO |
某固体混合物中含有Na2O2与NaHCO3,将其置于一密闭容器中,强热使之充分反应.下列有关说法正确的是( )
A、若剩余固体只为一种,则原混合物中
| ||
B、若剩余气体在标准状况下的相对分子质量为38,则原混合物中
| ||
C、若剩余气体只有一种,则原混合物中
| ||
D、若取16.2g剩余固体用盐酸溶解,当消耗0.3mol溶质时,恰好反应完且溶液呈中性,则原混合物中
|
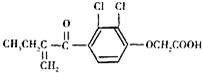 我国崇尚体育公平,倡导绿色奥运,而运动员服用兴奋剂事件有时有发生,图是兴奋剂利尿酸的结构.关于它的说法不正确的是( )
我国崇尚体育公平,倡导绿色奥运,而运动员服用兴奋剂事件有时有发生,图是兴奋剂利尿酸的结构.关于它的说法不正确的是( )| A、利尿酸的分子式为:C13H12O4Cl2 |
| B、1mol利尿酸最多可与5mol H2发生反应 |
| C、利尿酸所有碳原子可能共面 |
| D、利尿酸在一定条件下能发生消去、氧化、还原、水解、银镜等反应 |
下列有关电解质溶液关系正确的是( )
| A、等体积等浓度的两种弱酸盐NaA、NaB溶液中,离子总数一定相等 |
| B、等物质的量浓度的氯化钠和醋酸钠混合溶液中,微粒关系有c(Na+)=c(Cl-)+c(CH3COO-) |
| C、在NaHSO3溶液微粒由大到小的顺序为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3) |
| D、若弱酸的酸性H2A>H2B,则等物质的量浓度等体积的Na2A、Na2B溶液中,离子数目前者大于后者 |