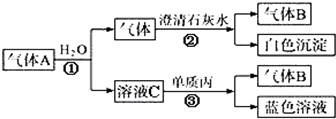
题目内容
(1)通常用小苏打的悬浊液除去CO2中的HCl,反应的离子方程式为: ,不能用NaOH溶液的原因是 ,也不能用Na2CO3的原因是 (均用离子方程式表示原因)
(2)把下列离子方程式改写成化学方程式:
CO32-+2H+═CO2↑+H2O
Ag++Cl-═AgCl↓ .
(2)把下列离子方程式改写成化学方程式:
CO32-+2H+═CO2↑+H2O
Ag++Cl-═AgCl↓
考点:离子方程式的书写
专题:离子反应专题
分析:(1)小苏打为碳酸氢钠,碳酸氢钠与盐酸反应生成二氧化碳和水;二氧化碳能够与氢氧化钠反应生成碳酸钠和水,违反了除杂原则;碳酸钠能够与二氧化碳反应生成碳酸氢钠,被提纯物质与提纯试剂发生了反应;
(2)离子方程式表示的是一类化学反应,离子方程式CO32-+2H+═CO2↑+H2O表示可溶性的碳酸盐与强酸反应生成可溶性的盐、二氧化碳和水;Ag++Cl-═AgCl↓表示硝酸银与盐酸和盐酸盐发生反应生成氯化银沉淀的一类反应.
(2)离子方程式表示的是一类化学反应,离子方程式CO32-+2H+═CO2↑+H2O表示可溶性的碳酸盐与强酸反应生成可溶性的盐、二氧化碳和水;Ag++Cl-═AgCl↓表示硝酸银与盐酸和盐酸盐发生反应生成氯化银沉淀的一类反应.
解答:
解:(1)通常用小苏打的悬浊液除去CO2中的HCl,二氧化碳不与碳酸氢钠反应,而氯化氢能够与碳酸氢钠反应,反应的离子方程式为:HCO3-+H+=H2O+CO2↑;由于氢氧化钠溶液能够与二氧化碳反应,所以不能用氢氧化钠溶液除去二氧化碳中的氯化氢,反应的离子方程式为:CO2+2OH-=H2O+CO32-;碳酸钠溶液能够与二氧化碳发生反应生成碳酸氢钠,所以也不能用碳酸氢钠溶液除去二氧化碳中的氯化氢,反应的离子方程式为:H2O+CO32-+CO2=2HCO3-,
故答案为:HCO3-+H+=H2O+CO2↑; CO2+2OH-=H2O+CO32-;H2O+CO32-+CO2=2HCO3-;
(2)CO32-+2H+═CO2↑+H2O表示可溶性的碳酸盐与强酸反应生成可溶性的盐、二氧化碳和水,如:Na2CO3+2HCl═CO2↑+H2O+NaCl;
Ag++Cl-═AgCl↓表示硝酸银与盐酸和盐酸盐发生反应生成氯化银沉淀,如:AgNO3+NaCl═AgCl↓+NaNO3,
故答案为:Na2CO3+2HCl═CO2↑+H2O+NaCl;AgNO3+NaCl═AgCl↓+NaNO3.
故答案为:HCO3-+H+=H2O+CO2↑; CO2+2OH-=H2O+CO32-;H2O+CO32-+CO2=2HCO3-;
(2)CO32-+2H+═CO2↑+H2O表示可溶性的碳酸盐与强酸反应生成可溶性的盐、二氧化碳和水,如:Na2CO3+2HCl═CO2↑+H2O+NaCl;
Ag++Cl-═AgCl↓表示硝酸银与盐酸和盐酸盐发生反应生成氯化银沉淀,如:AgNO3+NaCl═AgCl↓+NaNO3,
故答案为:Na2CO3+2HCl═CO2↑+H2O+NaCl;AgNO3+NaCl═AgCl↓+NaNO3.
点评:本题考查了离子方程式的书写、物质的分离与除杂,题目难度中等,注意掌握离子方程式的书写原则,明确物质的分离与除杂的原则及正确的操作方法.

练习册系列答案
相关题目
下列说法错误的是( )
| A、缺碘易患大脖子病 |
| B、聚氯乙烯塑料不可用来包装食品 |
| C、皮肤被烫伤或受浓硝酸腐蚀时,细胞结构将受到破坏 |
| D、由于淀粉在人体中会转化为氨基酸,因此每天都要摄入一定量的淀粉 |
氨基酸不能发生的反应是( )
| A、酯化反应 | B、与碱的中和反应 |
| C、成肽反应 | D、水解反应 |
“盖中盖”、“盖天力”等广告几乎无人不知,作为一种补钙剂,其中所含有的有效成分主要是“葡萄糖酸钙”,“葡萄糖酸钙”的化学式应为( )
| A、(C6H12O7)2Ca |
| B、(C6H11O7)2Ca |
| C、(C6H12O6)2Ca |
| D、(C6H12O8)2Ca |
下列各微粒的电子排布式或轨道表示式不符合能量最低原理的是( )
| A、O2-ls22s22p6 |
| B、S2-ls22s22p6 3s23p44s2 |
C、F  |
D、Na+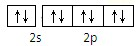 |
 中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题: